Współczesne zalecenia dotyczące podstawowego leczenia POChP. Nowe wytyczne kliniczne dotyczące leczenia powikłań POChP
1
Rosyjskie Towarzystwo Oddechowe
Federalna klinika
zalecenia dotyczące diagnozy i
leczenie
przewlekła choroba obturacyjna
płuca
2014
2
Zespół autorów
Chuchalin Alexander Grigorievich Dyrektor Federalnej Państwowej Instytucji Budżetowej „Instytut Badawczy Pulmonologii” FMBA
Rosja, prezes zarządu Rosyjskiego Towarzystwa Chorób Układu Oddechowego, główny niezależny specjalista pulmonolog
Ministerstwo Zdrowia Federacji Rosyjskiej, akademik Rosyjskiej Akademii Nauk Medycznych, profesor, doktor nauk medycznych.
Aisanow Zaurbek Ramazanowicz
Kierownik Katedry Fizjologii Klinicznej i Badań Klinicznych, Federalna Państwowa Instytucja Budżetowa „Instytut Badawczy Pulmonologii” FMBA Rosji, profesor, doktor nauk medycznych.
Awdejew Siergiej Nikołajewicz
Zastępca dyrektora ds. Pracy naukowej, kierownik wydziału klinicznego Federalnej Państwowej Instytucji Budżetowej „Instytut Badawczy Pulmonologii” FMBA Rosji, profesor, doktor nauk medycznych.
Andriej Bielewski
Stanisławowicz
Profesor Katedry Pulmonologii Państwowej Budżetowej Wyższej Szkoły Zawodowej
RNRMU nazwany na cześć N.I. Pirogova, kierownik laboratorium rehabilitacyjnego
FSBI „Instytut Badawczy Pulmonologii” FMBA Rosji
, profesor, doktor nauk medycznych
Leszczenko Igor Wiktorowicz
Profesor Katedry Ftyzjologii i Pulmonologii Państwowej Budżetowej Instytucji Edukacyjnej Wyższego Szkolnictwa Zawodowego USMU, główny niezależny pulmonolog Ministerstwa Zdrowia
Obwód swierdłowski i Wydział Zdrowia Jekaterynburga, dyrektor naukowy kliniki „Stowarzyszenie Medyczne „Nowy Szpital”, profesor, doktor nauk medycznych, honorowy doktor Rosji,
Meshcheryakova Natalia Nikołajewna
Profesor nadzwyczajny Katedry Pulmonologii, Państwowej Budżetowej Instytucji Edukacyjnej Wyższego Szkolnictwa Zawodowego, Rosyjskiego Narodowego Uniwersytetu Medycznego im. N.I. Pirogova, wiodący badacz w laboratorium rehabilitacyjnym
FSBI „Instytut Badawczy Pulmonologii” FMBA Rosji, dr.
Ovcharenko Swietłana Iwanowna
Profesor zwyczajny, Katedra Wydziału Terapii nr 1, Wydział Lekarski, Państwowa Budżetowa Instytucja Oświatowa Wyższej Szkoły Zawodowej First
MSMU im. ICH. Sechenova, profesor, doktor nauk medycznych,
Honorowy Doktor Federacji Rosyjskiej
Szmelew Jewgienij Iwanowicz
Kierownik Zakładu Diagnostyki Różnicowej Gruźlicy Centralnego Instytutu Badawczego Chorób Zakaźnych Rosyjskiej Akademii Nauk Medycznych, doktor nauk medycznych. Nauki, profesor, doktor nauk medycznych, zasłużony naukowiec Federacji Rosyjskiej.
3
SPIS TREŚCI
1.
Metodologia
4
2.
Definicja POChP i epidemiologia
6
3.
Obraz kliniczny POChP
8
4.
Zasady diagnostyczne
11
5.
Testy funkcjonalne w diagnostyce i monitorowaniu
14
przebieg POChP
6.
Diagnostyka różnicowa POChP
18
7.
Współczesna klasyfikacja POChP. Wyczerpujący
20
ocena dotkliwości.
8.
Terapia stabilnej POChP
24
9.
Zaostrzenie POChP
29
10.
Leczenie zaostrzeń POChP
31
11.
POChP i choroby pokrewne
34
12.
Rehabilitacja i edukacja pacjenta
36
4
1. Metodologia
Metody stosowane w celu gromadzenia/wyboru materiału dowodowego:
wyszukiwanie w elektronicznych bazach danych.
Opis metod stosowanych w celu gromadzenia/wyboru materiału dowodowego: Podstawą merytoryczną rekomendacji są publikacje zawarte w
Biblioteki Cochrane, bazy danych EMBASE i MEDLINE. Głębokość poszukiwań wynosiła 5 lat.
Metody stosowane do oceny jakości i siły dowodów:
Konsensus ekspertów;
Ocena istotności zgodnie ze schematem ocen (patrz tabela 1).
Tabela 1. Schemat oceny siły rekomendacji.
Poziomy
dowód
Opis
1++
Wysokiej jakości metaanalizy, systematyczne przeglądy randomizowanych badań kontrolowanych (RCT) lub
RCT z bardzo niskim ryzykiem błędu systematycznego
1+
Jakościowo przeprowadzone metaanalizy, systematyczne lub
RCT z niskim ryzykiem błędu systematycznego
1-
Metaanalizy, analizy systematyczne lub RCT obarczone wysokim ryzykiem błędu systematycznego
2++
Wysokiej jakości przeglądy systematyczne badań kliniczno-kontrolnych lub badań kohortowych.
Wysokiej jakości przeglądy badań kliniczno-kontrolnych lub badań kohortowych z bardzo niskim ryzykiem efektów zakłócających lub stronniczości oraz umiarkowanym prawdopodobieństwem związku przyczynowego
2+
Dobrze przeprowadzone badania kliniczno-kontrolne lub badania kohortowe z umiarkowanym ryzykiem efektów zakłócających lub stronniczości oraz umiarkowanym prawdopodobieństwem związku przyczynowego
2-
Badania kliniczno-kontrolne lub badania kohortowe z wysokim ryzykiem efektów zakłócających lub stronniczości oraz umiarkowanym prawdopodobieństwem związku przyczynowego
3
Badania nieanalityczne (np. opisy przypadków, serie przypadków)
4
Opinia eksperta
Metody stosowane do analizy dowodów:
Recenzje opublikowanych metaanaliz;
Przeglądy systematyczne z tabelami dowodowymi.
Opis metod stosowanych do analizy materiału dowodowego:
Wybierając publikacje jako potencjalne źródła dowodów, metodologia zastosowana w każdym badaniu jest sprawdzana pod kątem jej wiarygodności. Wynik badania wpływa na poziom dowodów przypisanych publikacji, co z kolei wpływa na siłę powstałych rekomendacji.
5
Badanie metodologiczne opiera się na kilku kluczowych pytaniach, które koncentrują się na tych cechach projektu badania, które mają istotny wpływ na ważność wyników i wniosków. Te kluczowe pytania mogą się różnić w zależności od rodzaju badań i kwestionariuszy stosowanych w celu standaryzacji procesu oceny publikacji. W rekomendacjach wykorzystano kwestionariusz MERGE opracowany przez
Departament Zdrowia Nowej Południowej Walii. Kwestionariusz ten przeznaczony jest do szczegółowej oceny i dostosowania do wymagań
Rosyjskiego Towarzystwa Chorób Oddechowych (RRO) w celu zachowania optymalnej równowagi pomiędzy rygorem metodologicznym a możliwością praktycznego zastosowania.
Na proces oceny może oczywiście wpływać również czynnik subiektywny.
Aby zminimalizować potencjalną stronniczość, każde badanie oceniano niezależnie, tj. co najmniej dwóch niezależnych członków grupy roboczej.
Wszelkie różnice w ocenach były omawiane przez całą grupę jako całość.
Jeżeli osiągnięcie konsensusu nie było możliwe, angażowano niezależnego eksperta.
Tabele dowodowe:
Tabele dowodowe zostały wypełnione przez członków grupy roboczej.
Metody stosowane przy formułowaniu rekomendacji:
Konsensus ekspertów.
Tabela 2. Schemat oceny siły rekomendacji
Siła
Opis
A
Co najmniej jedna metaanaliza, przegląd systematyczny lub RCT z oceną 1++, mające bezpośrednie zastosowanie do populacji docelowej i wykazujące solidność wyników, lub zbiór dowodów obejmujący wyniki badań z oceną 1+, bezpośrednio odnoszący się do populacji docelowej i wykazujący ogólne wyniki wytrzymałości
W
Zbiór dowodów obejmujący wyniki badań z oceną 2++, które mają bezpośrednie zastosowanie w populacji docelowej i wykazują ogólną solidność wyników, lub dowody ekstrapolowane z badań z oceną 1++ lub 1+
Z
Zbiór dowodów obejmujący wnioski z badań z oceną 2+, bezpośrednio odnoszący się do populacji docelowej i wykazujący ogólną solidność wyników; lub ekstrapolowane dowody z badań z oceną 2++
D
Dowód poziomu 3 lub 4; lub ekstrapolowane dowody z badań z oceną 2+
Punkty dobrych praktyk (GPP):
Zalecana dobra praktyka opiera się na doświadczeniu klinicznym członków grupy roboczej ds. wytycznych.
Analiza ekonomiczna:
6
Nie przeprowadzono analizy kosztów ani przeglądu publikacji farmakoekonomicznych.
Metoda walidacji rekomendacji:
Ocena eksperta zewnętrznego;
Wewnętrzna ocena ekspercka.
Opis metody walidacji rekomendacji:
Te projekty zaleceń zostały zweryfikowane przez niezależnych ekspertów, których poproszono o skomentowanie przede wszystkim zakresu, w jakim interpretacja dowodów leżących u podstaw zaleceń jest zrozumiała.
Otrzymano uwagi od lekarzy podstawowej opieki zdrowotnej i lokalnych terapeutów dotyczące przejrzystości zaleceń i ich oceny znaczenia zaleceń jako narzędzia pracy w codziennej praktyce.
Wstępną wersję wysłano także do recenzenta niebędącego lekarzem w celu uzyskania komentarzy z punktu widzenia pacjenta.
Uwagi otrzymane od ekspertów zostały starannie usystematyzowane i omówione przez przewodniczącego i członków grupy roboczej. Każdy punkt został omówiony, a wynikające z niego zmiany w zaleceniach zostały odnotowane. W przypadku braku zmian zapisywano przyczyny odmowy wprowadzenia zmian.
Konsultacje i ekspertyza:
Wstępna wersja została zamieszczona i stała się przedmiotem szerokiej dyskusji na stronie internetowej
RPO, aby zapewnić osobom nieuczestniczącym w kongresie możliwość wzięcia udziału w dyskusji i udoskonaleniu rekomendacji.
Projekt wytycznych został także poddany recenzji niezależnych ekspertów, których poproszono o uwagi przede wszystkim w zakresie przejrzystości i dokładności interpretacji podstawy dowodowej leżącej u podstaw zaleceń.
Grupa robocza:
W celu ostatecznej weryfikacji i kontroli jakości rekomendacje zostały ponownie przeanalizowane przez członków grupy roboczej, którzy stwierdzili, że wszystkie uwagi i uwagi ekspertów zostały wzięte pod uwagę, a ryzyko błędów systematycznych przy opracowywaniu rekomendacji zostało zminimalizowane.
Podstawowe zalecenia:
Siła zaleceń (A – D), poziomy dowodów (1++, 1+, 1-, 2++, 2+, 2-, 3, 4) oraz punkty dobrych praktyk (GPP) podano w tekście. zalecenia.
2. Definicja POChP i epidemiologia
Definicja
POChP jest chorobą, której można zapobiegać i którą można leczyć
charakteryzuje się utrzymującym się ograniczeniem prędkości lotu
przepływ, który zwykle ma charakter postępujący i wiąże się z ciężką przewlekłą chorobą
reakcja zapalna płuc na działanie patogennych cząstek lub gazów.
U niektórych pacjentów mogą wystąpić zaostrzenia i choroby współistniejące
ogólne nasilenie POChP (ZŁOTO 2014).
Tradycyjnie POChP łączy przewlekłe zapalenie oskrzeli i rozedmę płuc
Przewlekłe zapalenie oskrzeli jest zwykle definiowane klinicznie jako obecność plwociny powodującej kaszel przez co najmniej 3 miesiące w ciągu następnych 2 lat.
7
Rozedmę płuc definiuje się morfologicznie jako obecność trwałego poszerzenia dróg oddechowych dystalnie od oskrzelików końcowych, związanego z zniszczeniem ścian pęcherzyków płucnych, niezwiązanego ze zwłóknieniem.
U chorych na POChP najczęściej występują oba schorzenia, a w niektórych przypadkach kliniczne ich rozróżnienie we wczesnych stadiach choroby jest dość trudne.
Pojęcie POChP nie obejmuje astmy oskrzelowej i innych chorób związanych ze słabo odwracalną obturacją oskrzeli (mukowiscydoza, rozstrzenie oskrzeli, zarostowe zapalenie oskrzelików).
Epidemiologia
Rozpowszechnienie
POChP jest obecnie problemem globalnym. W niektórych krajach świata częstość występowania POChP jest bardzo wysoka (ponad 20% w Chile), w innych mniejsza (około 6% w Meksyku). Przyczyną tej zmienności są różnice w stylu życia, zachowaniu i narażeniu ludzi na różnorodne szkodliwe czynniki.
Jedno z badań globalnych (projekt BOLD) dostarczyło wyjątkowej możliwości oszacowania częstości występowania POChP przy użyciu standardowych kwestionariuszy i testów czynnościowych płuc w populacjach dorosłych powyżej 40. roku życia, zarówno w krajach rozwiniętych, jak i rozwijających się. Rozpowszechnienie
POChP w stopniu II i wyższym (GOLD 2008) według badania BOLD wśród osób powyżej 40. roku życia wynosiła 10,1±4,8%; w tym dla mężczyzn – 11,8±7,9% i dla kobiet – 8,5±5,8%. Według badania epidemiologicznego dotyczącego częstości występowania POChP w regionie Samara (mieszkańcy w wieku 30 lat i starsi) częstość występowania POChP w całej próbie wyniosła 14,5% (mężczyźni – 18,7%, kobiety – 11,2%). Według wyników innego rosyjskiego badania przeprowadzonego w obwodzie irkuckim częstość występowania POChP u osób powyżej 18. roku życia wśród ludności miejskiej wynosiła 3,1%, wśród ludności wiejskiej
6,6 %.
Częstość występowania POChP wzrasta wraz z wiekiem: w grupie wiekowej od 50. roku życia do
69 lat, na tę chorobę chorowało 10,1% mężczyzn w mieście i 22,6%
na wsi. Niemal co drugi mężczyzna po 70. roku życia mieszkający na wsi rozpoznał POChP.
Śmiertelność
Według WHO POChP jest obecnie czwartą najczęstszą przyczyną zgonów na świecie. Oznacza to, że co roku na POChP umiera około 2,75 miliona osób
4,8% wszystkich przyczyn zgonów. W Europie śmiertelność z powodu POChP różni się znacznie, od
0,20 na 100 000 mieszkańców w Grecji, Szwecji, Islandii i Norwegii, do 80 na 100 000 mieszkańców na Ukrainie i w Rumunii.
W okresie od 1990 do 2000 r. śmiertelność z powodu chorób układu krążenia w ogóle i z powodu udaru mózgu spadła odpowiednio o 19,9% i 6,9%, podczas gdy śmiertelność z powodu POChP wzrosła o 25,5%. Szczególnie wyraźny wzrost śmiertelności z powodu
POChP występuje u kobiet.
Czynnikami predykcyjnymi śmiertelności u chorych na POChP są takie czynniki, jak stopień obturacji oskrzeli, stan odżywienia (wskaźnik masy ciała), wytrzymałość fizyczna w teście 6-minutowego marszu oraz nasilenie duszności, częstotliwość i nasilenie zaostrzeń, nadciśnienie płucne. .
Głównymi przyczynami zgonów chorych na POChP są niewydolność oddechowa (RF), rak płuc, choroby układu krążenia oraz nowotwory o innej lokalizacji.
Społeczno-ekonomiczne znaczenie POChP
W krajach rozwiniętych całkowite koszty ekonomiczne związane z POChP w strukturze chorób płuc zajmują 2. miejsce po raku płuca i 1. miejsce
8 pod względem kosztów bezpośrednich, przekraczających 1,9-krotnie koszty bezpośrednie astmy oskrzelowej.
Koszty ekonomiczne na pacjenta związanego z POChP są trzykrotnie wyższe niż w przypadku pacjenta z astmą oskrzelową. Z nielicznych raportów na temat bezpośrednich kosztów leczenia POChP wynika, że ponad 80% kosztów przeznacza się na opiekę szpitalną, a niecałe 20% na opiekę ambulatoryjną. Stwierdzono, że 73% kosztów przypada na 10% pacjentów z ciężką chorobą. Największe szkody ekonomiczne wiąże się z leczeniem zaostrzeń POChP. W Rosji obciążenie ekonomiczne POChP, biorąc pod uwagę koszty pośrednie, w tym absencję (absencję) i prezenteizm (mniejsza efektywność pracy ze względu na zły stan zdrowia), wynosi 24,1 miliarda rubli.
3. Obraz kliniczny POChP
W warunkach narażenia na czynniki ryzyka (palenie tytoniu czynne i bierne, zanieczyszczenia egzogenne, paliwo bioorganiczne itp.) POChP zwykle rozwija się powoli i postępuje stopniowo. Osobliwością obrazu klinicznego jest to, że przez długi czas choroba postępuje bez wyraźnych objawów klinicznych (3, 4; D).
Pierwszymi objawami, z którymi pacjenci zgłaszają się do lekarza, jest kaszel, często z odkrztuszaniem plwociny i/lub duszność. Objawy te są najbardziej widoczne rano. W zimnych porach roku występują „częste przeziębienia”.
Oto obraz kliniczny początku choroby,
co lekarz uważa za przejaw zapalenia oskrzeli palacza, a diagnoza POChP na tym etapie praktycznie nie jest stawiana.
Przewlekły kaszel, będący zwykle pierwszym objawem POChP, jest często bagatelizowany przez pacjentów, uznawany za spodziewaną konsekwencję palenia i/lub narażenia na niekorzystne czynniki środowiskowe. Pacjenci zwykle wytwarzają niewielką ilość lepkiej plwociny. Zwiększony kaszel i plwocina występuje najczęściej w miesiącach zimowych, podczas zaostrzeń infekcyjnych.
Duszność jest najważniejszym objawem POChP (4; D). Często jest powodem poszukiwania pomocy lekarskiej i główną przyczyną ograniczenia aktywności zawodowej pacjenta. Wpływ duszności na zdrowie ocenia się za pomocą kwestionariusza British Medical Council.
(MRC). Początkowo duszność pojawia się przy stosunkowo dużej aktywności fizycznej, takiej jak bieganie po równym podłożu lub wchodzenie po schodach. W miarę postępu choroby duszność nasila się i może ograniczać nawet codzienną aktywność, a później pojawia się w spoczynku, zmuszając pacjenta do pozostania w domu (tab. 3). Ponadto ocena duszności w skali MRC jest czułym narzędziem przewidywania przeżycia chorych na POChP.
Tabela 3. Ocena duszności według skali Medical Research Council Scale (MRC)
Skala duszności.
Stopień ważności
Opis
0 nie
Brakuje mi tchu tylko podczas intensywnego wysiłku fizycznego
1 światło
Brakuje mi tchu, gdy chodzę szybko po równym terenie lub wspinam się na łagodne wzniesienie
2 średnie
Duszność powoduje, że chodzę po równym podłożu wolniej niż osoby w tym samym wieku lub przestaję oddychać, gdy idę po równym podłożu w zwykłym tempie
9 3 ciężki
Brakuje mi tchu po przejściu około 100 m lub po kilkuminutowym marszu po równym terenie
4 bardzo ciężkie
Brakuje mi tchu, aby wyjść z domu lub brakuje mi tchu podczas ubierania się lub rozbierania
Opisując obraz kliniczny POChP, należy wziąć pod uwagę cechy charakterystyczne tej konkretnej choroby: subkliniczny początek, brak specyficznych objawów oraz stały postęp choroby.
Nasilenie objawów różni się w zależności od fazy choroby (przebieg stabilny lub zaostrzenie). Stan, w którym nasilenie objawów nie zmienia się istotnie na przestrzeni tygodni, a nawet miesięcy, należy uznać za stabilny, a w tym przypadku progresję choroby można wykryć dopiero po długotrwałej (6-12 miesięcy) obserwacji pacjenta.
Istotny wpływ na obraz kliniczny mają zaostrzenia choroby – okresowo występujące pogorszenie stanu zdrowia (trwające co najmniej 2-3 dni), któremu towarzyszy wzrost nasilenia objawów i zaburzeń czynnościowych. W okresie zaostrzeń następuje zwiększenie nasilenia hiperinflacji i tzw. pułapek powietrznych w połączeniu ze zmniejszonym przepływem wydechowym, co prowadzi do zwiększonej duszności, której zwykle towarzyszy pojawienie się lub nasilenie odległego świszczącego oddechu, uczucie ucisku w klatce piersiowej i zmniejszenie tolerancji wysiłku.
Ponadto intensywność kaszlu wzrasta, zmienia się
(zwiększa lub gwałtownie maleje) ilość plwociny, charakter jej separacji, kolor i lepkość. Jednocześnie pogarszają się wskaźniki funkcji oddychania zewnętrznego i gazów we krwi: zmniejszają się wskaźniki prędkości (FEV).
1
itp.), może wystąpić hipoksemia, a nawet hiperkapnia.
Przebieg POChP to naprzemienna faza stabilna i zaostrzenie choroby, ale różni się ona w zależności od osoby. Jednakże postęp POChP jest częsty, zwłaszcza jeśli pacjent w dalszym ciągu jest narażony na wdychane cząstki chorobotwórcze lub gazy.
Obraz kliniczny choroby również poważnie zależy od fenotypu choroby i odwrotnie, fenotyp determinuje charakterystykę objawów klinicznych
POChP Od wielu lat istnieje podział chorych na fenotypy rozedmowe i oskrzelowe.
Typ oskrzelowy charakteryzuje się przewagą objawów zapalenia oskrzeli
(kaszel, wytwarzanie plwociny). Rozedma płuc w tym przypadku jest mniej wyraźna. Przeciwnie, w typie rozedmowym rozedma płuc jest głównym objawem patologicznym, duszność przeważa nad kaszlem. Jednak w praktyce klinicznej bardzo rzadko udaje się rozróżnić fenotyp POChP w postaci rozedmy lub zapalenia oskrzeli w tzw. „czysta” forma (bardziej poprawne byłoby mówienie o głównie zapaleniu oskrzeli lub głównie rozedmowym fenotypie choroby).
Cechy fenotypów przedstawiono bardziej szczegółowo w tabeli 4.
Cele leczenia POChP można podzielić na 4 główne grupy:
Eliminacja objawów i poprawa jakości życia;
Redukcja przyszłych ryzyk itp.; zapobieganie zaostrzeniom;
Spowolnienie postępu choroby;
Zmniejszona śmiertelność.
Leczenie POChP obejmuje podejście farmakologiczne i niefarmakologiczne. Leczenie farmakologiczne obejmuje leki rozszerzające oskrzela, połączenia ICS i długo działających leków rozszerzających oskrzela (LABA), inhibitory fosfodiesterazy-4, teofilinę oraz szczepionki przeciw grypie i pneumokokom.
Opcje niefarmakologiczne obejmują rzucenie palenia, rehabilitację pulmonologiczną, tlenoterapię, wspomaganie oddychania i operację.
Leczenie zaostrzeń POChP rozważa się osobno.
3.1 Leczenie zachowawcze.
Rzucić palenie.
U wszystkich chorych na POChP zaleca się zaprzestanie palenia.Uwagi. Zaprzestanie palenia jest najskuteczniejszą interwencją i ma duży wpływ na postęp POChP. Zwykła porada lekarza prowadzi do zaprzestania palenia u 7,4% pacjentów (o 2,5% więcej niż w grupie kontrolnej), a po 3-10-minutowej konsultacji wskaźnik zaprzestania palenia sięga około 12%. W przypadku dłuższych i bardziej złożonych interwencji, które obejmują szkolenie umiejętności, szkolenie w zakresie rozwiązywania problemów i wsparcie psychospołeczne, wskaźnik rzucania palenia może osiągnąć 20–30%.
W przypadku braku przeciwwskazań zaleca się leczenie farmakologiczne uzależnienia od tytoniu w celu wsparcia wysiłków na rzecz zaprzestania palenia.
Uwagi. Farmakoterapia skutecznie wspiera wysiłki w rzucaniu palenia. Leki pierwszego rzutu w leczeniu uzależnienia od tytoniu obejmują wareniklinę, bupropion o przedłużonym uwalnianiu i nikotynowe leki zastępcze.
Połączenie porady lekarskiej, grupy wsparcia, szkolenia umiejętności i nikotynowej terapii zastępczej prowadzi do rzucenia palenia w 35% przypadków po 1 roku, podczas gdy 22% pozostaje niepalących po 5 latach.
Zasady farmakoterapii stabilnej POChP.
Klasy farmakologiczne leków stosowanych w leczeniu POChP przedstawiono w tabeli. 5.
Tabela 5. Klasy farmakologiczne leków stosowanych w leczeniu POChP.
| Klasa farmakologiczna | Narkotyki |
| KDBA | Salbutamol Fenoterol |
| DDBA | Vilanterol Indakaterol Salmeterol Olodaterol Formoterol |
| KDAH | Bromek ipratropium |
| DDAH | Bromek aklidyny Bromek glikopironium Bromek tiotropium Bromek umeklidyniowy |
| ICS | Beklometazon Budezonid Mometazon Flutykazon Flutykazonu furoinian Cyklezonid |
| Naprawiono kombinacje LADAH/LABA | Bromek glikopironium/indakaterol Bromek tiotropium/olodaterol Bromek umeklidyniowy/wilanterol Bromek aklidyny/formoterol |
| Naprawiono kombinacje ICS/LABA | Beklometazon/formoterol Budezonid/formoterol Flutykazon/salmeterol Flutykazonu furoinian/wilanterol |
| Inhibitory fosfodiesterazy-4 | Roflumilast |
| Inny | Teofilina |
Notatka. SABA – krótko działający β2-agoniści, CDAC – krótko działające leki przeciwcholinergiczne, LABA – długo działający β2-agoniści, LAAC – długo działające leki przeciwcholinergiczne.
Przepisując farmakoterapię, zaleca się postawić sobie za cel osiągnięcie kontroli objawów i zmniejszenie przyszłego ryzyka itp.; zaostrzenia POChP i śmiertelność (Załącznik G5).
Uwagi. Zaleca się, aby decyzję o kontynuacji lub zakończeniu leczenia podjąć w oparciu o zmniejszenie przyszłego ryzyka (zaostrzeń). Dzieje się tak dlatego, że nie wiadomo, w jaki sposób zdolność leku do poprawy czynności płuc lub łagodzenia objawów koreluje z jego zdolnością do zmniejszania ryzyka zaostrzeń POChP. Do chwili obecnej nie ma przekonujących dowodów na to, że jakakolwiek swoista farmakoterapia spowalnia postęp choroby (oceniany na podstawie średniego tempa spadku minimalnej wartości FEV1) lub zmniejsza śmiertelność, chociaż opublikowano wstępne dane sugerujące taki efekt.
Leki rozszerzające oskrzela.
Do leków rozszerzających oskrzela zalicza się β2-agonistów i leki antycholinergiczne, w tym leki krótko działające (czas działania 3-6 godzin) i długo działające (czas działania 12-24 godziny).
Zaleca się, aby wszystkim pacjentom z POChP przepisano krótko działający lek rozszerzający oskrzela do stosowania w razie potrzeby.
Siła zalecenia: A (poziom dowodu: 1).
Uwagi. W razie potrzeby u pacjentów leczonych LABD możliwe jest także zastosowanie krótko działających leków rozszerzających oskrzela. Jednocześnie regularne stosowanie dużych dawek krótko działających leków rozszerzających oskrzela (w tym za pomocą nebulizatora) u pacjentów otrzymujących LABD nie jest uzasadnione i powinno być stosowane jedynie w najtrudniejszych przypadkach. W takich sytuacjach należy w pełni ocenić potrzebę stosowania LABD i zdolność pacjenta do prawidłowego wykonywania inhalacji.
β2-agoniści.
W leczeniu POChP zaleca się stosowanie następujących długo działających β2-agonistów (LABA): formoterol, salmeterol, indakaterol, olodaterol (Załącznik G6).
Siła zalecenia: A (poziom dowodu: 1).
Uwagi. Pod względem wpływu na FEV1 i duszność indakaterol i olodaterol są co najmniej tak samo dobre jak formoterol, salmeterol i bromek tiotropium. Pod względem wpływu na ryzyko umiarkowanych/ciężkich zaostrzeń LABA (indakaterol, salmeterol) ustępują bromkowi tiotropium.
Podczas leczenia chorych na POChP ze współistniejącymi chorobami układu krążenia zaleca się ocenę ryzyka wystąpienia powikłań sercowo-naczyniowych przed przepisaniem LABA.
Uwagi. Aktywacja receptorów β-adrenergicznych w sercu przez β2-agonistów może prawdopodobnie powodować niedokrwienie, niewydolność serca, zaburzenia rytmu, a także zwiększać ryzyko nagłej śmierci. Jednakże w kontrolowanych badaniach klinicznych u pacjentów z POChP nie znaleziono dowodów na zwiększenie częstości występowania zaburzeń rytmu, zgonów z przyczyn sercowo-naczyniowych lub ogólnej śmiertelności w przypadku stosowania β2-agonistów.
W leczeniu POChP, w odróżnieniu od astmy, LABA można stosować w monoterapii (bez ICS).
Leki antycholinergiczne.
W leczeniu POChP zaleca się stosowanie następujących długo działających leków przeciwcholinergicznych (LAA): bromek tiotropium, bromek aklidyny, bromek glikopironium, bromek umeklidyniowy (Załącznik D6).
Siła zalecenia: A (poziom dowodu: 1).
Uwagi. Bromek tiotropium ma największą bazę dowodów wśród DDAC. Bromek tiotropium zwiększa czynność płuc, łagodzi objawy, poprawia jakość życia i zmniejsza ryzyko zaostrzeń POChP.
Bromek aklidyny i bromek glikopironium poprawiają czynność płuc, jakość życia i zmniejszają potrzebę stosowania leków doraźnych. W badaniach trwających do 1 roku bromek aklidyny, bromek glikopironium i bromek umeklidyniowy zmniejszały ryzyko zaostrzeń POChP, ale dotychczas nie przeprowadzono długoterminowych badań trwających dłużej niż 1 rok, podobnych do tych dotyczących bromku tiotropium.
Wziewne leki przeciwcholinergiczne są na ogół dobrze tolerowane, a działania niepożądane (AE) związane z ich stosowaniem występują stosunkowo rzadko.
U chorych na POChP i współistniejące choroby układu krążenia zaleca się stosowanie LAMA.
Siła zalecenia: A (poziom dowodu: 1).
Uwagi. Chociaż podejrzewa się, że krótko działające leki przeciwcholinergiczne (SAA) mogą powodować sercowe zdarzenia niepożądane, nie ma doniesień o zwiększonej częstości występowania kardiologicznych zdarzeń niepożądanych w przypadku SAA. W 4-letnim badaniu UPLIFT u pacjentów leczonych bromkiem tiotropium występowało znacznie mniej zdarzeń sercowo-naczyniowych i ogólnej śmiertelności niż u pacjentów w grupie placebo. W badaniu TIOSPIR (mediana czasu leczenia 2,3 roku) stwierdzono, że inhalator w postaci płynnego bromku tiotropium jest wysoce bezpieczny, bez różnicy w porównaniu z inhalatorem suchego proszku bromku tiotropium pod względem śmiertelności, poważnych kardiologicznych działań niepożądanych i zaostrzeń POChP.
Kombinacje leków rozszerzających oskrzela.
Zaleca się łączenie leków rozszerzających oskrzela o różnych mechanizmach działania w celu uzyskania większego rozszerzenia oskrzeli i złagodzenia objawów.
Siła zalecenia: A (poziom dowodu: 1).
Uwagi. Na przykład połączenie CDAC z SABA lub LABA poprawia FEV1 w większym stopniu niż którykolwiek pojedynczy składnik. SABA lub LABA można podawać w połączeniu z LAMA, jeśli monoterapia LAMA nie zapewnia wystarczającego złagodzenia objawów.
W leczeniu POChP zaleca się stosowanie stałych kombinacji LAMA/LABA: bromek glikopironium/indakaterol, bromek tiotropium/olodaterol, bromek umeklidyniowy/wilanterol, bromek aklidyniowy/formoterol.
Siła zalecenia: A (poziom dowodu: 1).
Uwagi. Kombinacje te wykazały przewagę nad placebo i jego monoskładnikami pod względem wpływu na minimalną FEV1, duszność i jakość życia, nie ustępując im pod względem bezpieczeństwa. W porównaniu z bromkiem tiotropium, wszystkie połączenia LAMA/LABA wykazały lepszy wpływ na czynność płuc i jakość życia. Pod względem wpływu na duszność nie wykazano korzyści ze stosowania skojarzenia bromku umeklidyniowego z wilanterolem, a pod względem wpływu na PHI tylko bromek tiotropium z olodaterolem był znacząco lepszy od monoterapii bromkiem tiotropium.
Jednocześnie połączenia LAMA/LABA nie wykazały dotychczas przewagi nad monoterapią bromkiem tiotropium pod względem wpływu na ryzyko umiarkowanych/ciężkich zaostrzeń POChP.
Wziewne glikokortykosteroidy i ich połączenia z agonistami β2-adrenergicznymi.
Zaleca się przepisywanie ICS wyłącznie jako uzupełnienie trwającej terapii LABD u pacjentów z POChP, astmą w wywiadzie i eozynofilią we krwi (zawartość eozynofili we krwi poza zaostrzeniem wynosi ponad 300 komórek w 1 µl).
Poziom siły rekomendacji B (poziom dowodów 1).
Uwagi. W astmie działanie terapeutyczne i niepożądane ICS zależy od zastosowanej dawki, natomiast w POChP nie ma takiej zależności od dawki, a w badaniach długoterminowych stosowano jedynie średnie i duże dawki ICS. Nie można przewidzieć reakcji pacjentów z POChP na leczenie wziewnymi kortykosteroidami na podstawie odpowiedzi na leczenie doustnymi kortykosteroidami, wyników testu rozszerzania oskrzeli lub obecności nadreaktywności oskrzeli.
U pacjentów z POChP i częstymi zaostrzeniami (2 lub więcej umiarkowanych zaostrzeń w ciągu roku lub co najmniej 1 ciężkie zaostrzenie wymagające hospitalizacji) oprócz LABD zaleca się także wziewne wodorowęglany.
Poziom siły rekomendacji B (poziom dowodów 1).
Uwagi. Długotrwałe (6 miesięcy) leczenie ICS i skojarzeniem ICS/LABA zmniejsza częstość zaostrzeń POChP i poprawia jakość życia chorych.
ICS można stosować w ramach terapii podwójnej (LABA/ICS) lub potrójnej (LAMA/LABA/ICS). Terapię potrójną oceniano w badaniach, w których dodanie kombinacji ICS/LABA do leczenia bromkiem tiotropium spowodowało poprawę czynności płuc, jakości życia i dodatkowe zmniejszenie częstości występowania zaostrzeń, zwłaszcza ciężkich zaostrzeń. Terapia potrójna wymaga jednak dalszych badań w dłuższych badaniach.
U chorych na POChP obciążonych wysokim ryzykiem zaostrzeń i bez eozynofilii we krwi zaleca się przepisywanie leku LAMA lub ICS/LABA z tym samym poziomem wiarygodności.
Siła zalecenia: A (poziom dowodu: 1).
Uwagi. Głównym oczekiwanym efektem przepisania wziewnych wziewnych leków przeciwzapalnych pacjentom z POChP jest zmniejszenie ryzyka zaostrzeń. Pod tym względem ICS/LABA nie są lepsze od monoterapii LAMA (bromkiem tiotropium). Ostatnie badania pokazują, że połączenia ICS/LABA mają przewagę nad lekami rozszerzającymi oskrzela pod względem wpływu na ryzyko zaostrzeń tylko u pacjentów z eozynofilią we krwi.
Nie zaleca się stosowania ICS u chorych na POChP z zachowaną funkcją płuc i bez nawracających zaostrzeń w wywiadzie.
Poziom siły rekomendacji B (poziom dowodów 1).
Uwagi. Terapia ICS i kombinacjami ICS/LABA nie wpływa na tempo spadku FEV1 i śmiertelności w POChP.
Ze względu na ryzyko poważnych działań niepożądanych nie zaleca się stosowania ICS w leczeniu początkowym POChP.
Poziom siły rekomendacji B (poziom dowodów 1).
Uwagi. Do działań niepożądanych ICS należą pleśniawka i chrypka. Istnieją dowody na zwiększone ryzyko zapalenia płuc, osteoporozy i złamań podczas stosowania ICS i kombinacji ICS/LABA. Ryzyko zapalenia płuc u chorych na POChP zwiększa się w przypadku stosowania nie tylko flutykazonu, ale także innych wziewnych leków przeciwzapalnych. Rozpoczęciu leczenia ICS towarzyszyło zwiększone ryzyko rozwoju cukrzycy u pacjentów z patologią układu oddechowego.
Roflumilast.
Roflumilast hamuje odpowiedź zapalną związaną z POChP poprzez hamowanie enzymu fosfodiesterazy-4 i zwiększanie wewnątrzkomórkowego cyklicznego monofosforanu adenozyny.
Roflumilast zaleca się pacjentom z POChP i FEV1< 50% от должного, с хроническим бронхитом и частыми обострениями, несмотря на применение ДДБД для уменьшения частоты среднетяжелых и тяжелых обострений .
Siła zalecenia: A (poziom dowodu: 1).
Nie zaleca się stosowania roflumilastu w celu łagodzenia objawów POChP.
Siła zalecenia: A (poziom dowodu: 1).
Uwagi. Roflumilast nie jest lekiem rozszerzającym oskrzela, chociaż podczas długotrwałego leczenia pacjentów otrzymujących salmeterol lub bromek tiotropium roflumilast zwiększa FEV1 o dodatkowe 50–80 ml.
Wpływ roflumilastu na jakość życia i objawy jest słaby. Lek powoduje istotne działania niepożądane, których typowymi objawami są zaburzenia żołądkowo-jelitowe i bóle głowy, a także utrata masy ciała.
Doustne glikokortykosteroidy.
Zaleca się unikanie długotrwałego leczenia doustnymi kortykosteroidami u chorych na POChP, gdyż może to pogorszyć długoterminowe rokowanie.
Uwagi. Chociaż doustne kortykosteroidy w dużych dawkach (równe ≥30 mg doustnego prednizolonu na dobę) poprawiają czynność płuc w krótkim okresie, nie ma danych na temat korzyści wynikających z długotrwałego stosowania doustnych kortykosteroidów w małych, średnich i dużych dawkach z znaczny wzrost ryzyka działań niepożądanych. Jednak fakt ten nie uniemożliwia przepisywania doustnych kortykosteroidów podczas zaostrzeń.
Doustne kortykosteroidy powodują szereg poważnych działań niepożądanych; Jedną z najważniejszych w odniesieniu do POChP jest miopatia steroidowa, której objawami są osłabienie mięśni, zmniejszenie aktywności fizycznej i niewydolność oddechowa u pacjentów z wyjątkowo ciężką POChP.
Teofilina.
Nadal istnieją kontrowersje dotyczące dokładnego mechanizmu działania teofiliny, ale lek ten ma zarówno działanie rozszerzające oskrzela, jak i przeciwzapalne. Teofilina znacząco poprawia czynność płuc w POChP i prawdopodobnie poprawia czynność mięśni oddechowych, ale zwiększa również ryzyko działań niepożądanych. Istnieją dowody, że małe dawki teofiliny (100 mg 2 razy dziennie) statystycznie istotnie zmniejszają częstość zaostrzeń POChP.
Teofilinę zaleca się w leczeniu POChP jako terapię wspomagającą u pacjentów z ciężkimi objawami.
Uwagi. Wpływ teofiliny na czynność płuc i objawy POChP jest mniej wyraźny niż w przypadku formoterolu i salmeterolu, LABA.
Dokładny czas działania teofiliny, w tym nowoczesnych postaci o powolnym uwalnianiu, w POChP nie jest znany.
Przepisując teofilinę, zaleca się monitorowanie jej stężenia we krwi i dostosowywanie dawki leku w zależności od uzyskanych wyników.
Siła rekomendacji: C (poziom wiarygodności: 3).
Uwagi. Farmakokinetyka teofiliny charakteryzuje się różnicami międzyosobniczymi i tendencją do interakcji lekowych. Teofilina ma wąski zakres stężeń terapeutycznych i może powodować toksyczność. Do najczęstszych działań niepożądanych zalicza się podrażnienie żołądka, nudności, wymioty, biegunkę, zwiększoną diurezę, objawy pobudzenia ośrodkowego układu nerwowego (ból głowy, nerwowość, lęk, pobudzenie) i zaburzenia rytmu serca.
Leki antybakteryjne.
U chorych na POChP z rozstrzeniami oskrzeli i częstymi zaostrzeniami ropnymi zaleca się podawanie makrolidów (azytromycyny) w długotrwałej terapii.
Siła zalecenia: C (poziom dowodu: 2).
Uwagi. Niedawna metaanaliza wykazała, że długotrwałe leczenie makrolidami (erytromycyną, klarytromycyną i azytromycyną) w 6 badaniach trwających od 3 do 12 miesięcy spowodowało zmniejszenie o 37% częstości zaostrzeń POChP w porównaniu z placebo. Nastąpiło dodatkowe zmniejszenie liczby hospitalizacji o 21%. Powszechne stosowanie makrolidów ogranicza ryzyko wzrostu oporności bakterii na nie i wystąpienia działań niepożądanych (utrata słuchu, kardiotoksyczność).
Leki mukoaktywne.
W tej grupie znajduje się kilka substancji o różnych mechanizmach działania. W kilku badaniach oceniano regularne stosowanie leków mukolitycznych w POChP, a wyniki były sprzeczne.
Podawanie N-acetylocysteiny i karbocysteiny zalecane jest u chorych na POChP z fenotypem zapalenia oskrzeli i częstymi zaostrzeniami, szczególnie w przypadku niestosowania terapii ICS.
Siła rekomendacji: C (poziom wiarygodności: 3).
Uwagi. N-acetycysteina i karbocysteina mogą wykazywać właściwości przeciwutleniające i mogą zmniejszać liczbę zaostrzeń, ale nie poprawiają funkcji płuc ani jakości życia chorych na POChP.
Wybór inhalatora.
Zaleca się, aby na początku leczenia chorych na POChP uczyć prawidłowego stosowania inhalatorów, a następnie monitorować ich stosowanie podczas kolejnych wizyt.Uwagi. Znaczna część pacjentów popełnia błędy podczas stosowania inhalatorów. W przypadku stosowania inhalatora z odmierzoną dawką (MDI) koordynacja pomiędzy naciśnięciem przycisku a inhalacją nie jest wymagana, ale do wytworzenia wystarczającego przepływu wdechowego wymagana jest wystarczająca siła wdechowa. W przypadku stosowania inhalatora aerozolowego z odmierzaną dawką (MDI) nie jest wymagany duży przepływ wdechowy, ale pacjent musi być w stanie skoordynować aktywację inhalatora z rozpoczęciem wdechu.
Podczas przepisywania MDI zaleca się stosowanie spejrów w celu wyeliminowania problemów z koordynacją i ograniczenia odkładania się leku w górnych drogach oddechowych.
Siła rekomendacji: A (poziom wiarygodności: 3).
U pacjentów z ciężką POChP zaleca się preferowanie MDI (w tym ze spejserem) lub inhalator płynny.
Siła rekomendacji: A (poziom wiarygodności: 3).
Uwagi. Zalecenie to wynika z faktu, że u chorych na ciężką POChP podczas stosowania DPI przepływ wdechowy nie zawsze jest wystarczający.
Podstawowe zasady wyboru odpowiedniego inhalatora zostały opisane w Załączniku G7.
Taktyka leczenia stabilnej POChP.
Wszystkim chorym na POChP zaleca się wdrożenie środków niefarmakologicznych, przepisanie krótko działającego leku rozszerzającego oskrzela do stosowania w razie potrzeby, szczepienie przeciwko grypie i zakażeniom pneumokokowym oraz leczenie chorób współistniejących.Uwagi.Środki niefarmakologiczne obejmują rzucenie palenia, szkolenie w zakresie technik inhalacyjnych i podstawowej samokontroli, szczepienie przeciwko grypie i chorobie pneumokokowej, zachęcanie do aktywności fizycznej, ocenę potrzeby długotrwałej tlenoterapii (COT) i nieinwazyjnej wentylacji (NIV) ).
Wszystkim pacjentom z POChP zaleca się przepisanie LABA – połączenia LAMA/LABA lub jednego z tych leków w monoterapii (Załącznik B).
Siła zalecenia: A (poziom dowodu: 1).
Jeżeli u pacjenta występują ciężkie objawy (mMRC ≥2 lub CAT≥10), zaleca się przepisanie kombinacji LAMA/LABA natychmiast po rozpoznaniu POChP.
Siła zalecenia: A (poziom dowodu: 1).
Uwagi. Większość chorych na POChP zgłasza się do lekarza z ciężkimi objawami – dusznością i zmniejszoną tolerancją wysiłku. Podanie kombinacji LAMA/LABA pozwala, dzięki maksymalnemu rozszerzeniu oskrzeli, złagodzić duszność, zwiększyć tolerancję wysiłku i poprawić jakość życia pacjentów.
U pacjentów z łagodnymi objawami (mMRC) zaleca się początkową monoterapię jednym długo działającym lekiem rozszerzającym oskrzela (LABA lub LABA).< 2 или САТ.
Siła zalecenia: A (poziom dowodu: 1).
Uwagi. Zaletą LAMA jest to, że ma bardziej wyraźny wpływ na ryzyko zaostrzeń.
Jeżeli w trakcie monoterapii pojedynczym LABA objawy (duszność i zmniejszona tolerancja wysiłku) utrzymują się, zaleca się zintensyfikowanie terapii lekiem rozszerzającym oskrzela – przejście na kombinację LAMA/LABA (Załącznik B).
Przepisywanie kombinacji LAMA/LABA zamiast monoterapii jest również zalecane w przypadku nawracających zaostrzeń (2 lub więcej umiarkowanych zaostrzeń w ciągu roku lub co najmniej 1 ciężkie zaostrzenie wymagające hospitalizacji) u pacjentów bez objawów astmy i bez eozynofilii we krwi (Załącznik B).
Siła zalecenia: A (poziom dowodu: 2).
Uwagi. Skojarzenie bromku glikopironium LAMA/LABA/indakaterolu w badaniu FLAME zmniejszało ryzyko umiarkowanych/ciężkich zaostrzeń POChP skuteczniej niż połączenie ICS/LABA (flutykazon/salmeterol) u pacjentów z POChP z FEV1 25–60% przewidywaną i brak wysokiej eozynofilii we krwi.
Jeżeli podczas leczenia pojedynczym LABA u pacjenta z POChP i astmą lub eozynofilią we krwi wystąpią nawracające zaostrzenia, zaleca się przepisanie pacjentowi LABA/ICS (Załącznik B).
Siła zalecenia: A (poziom dowodu: 2).
Uwagi. Kryterium eozynofilii we krwi jest zawartość eozynofili we krwi (po zaostrzeniu) 300 komórek w 1 µl.
Jeżeli podczas leczenia skojarzeniem LAMA/LABA u chorych na POChP z astmą lub eozynofilią wystąpią nawracające zaostrzenia, wówczas zaleca się dodanie ICS (Załącznik B).
Siła zalecenia: A (poziom dowodu: 2).
Uwagi. Pacjent może także zastosować terapię potrójną w przypadku niewystarczającej skuteczności terapii ICS/LABA po dodaniu do leczenia LAMA.
Terapię potrójną LAMA/LABA/ICS można obecnie prowadzić na dwa sposoby: 1) stosując stałą kombinację LAMA/LABA i osobny inhalator ICS; 2) stosując stałą kombinację LABA/ICS i oddzielny inhalator LAMA. Wybór pomiędzy tymi metodami zależy od terapii początkowej, stosowania różnych inhalatorów i dostępności leków.
W przypadku powtarzających się zaostrzeń podczas leczenia skojarzeniem LAMA/LABA u pacjenta bez astmy i eozynofilii lub nawrotu zaostrzeń podczas terapii potrójnej (LAMA/LABA/ICS), zaleca się wyjaśnienie fenotypu POChP i przepisanie terapii specyficznej dla fenotypu (roflumilast , N-acetylocysteina, azytromycyna itp. – Załącznik B).
Siła rekomendacji: B (poziom wiarygodności: 3).
Nie zaleca się zmniejszania dawki leku rozszerzającego oskrzela (w przypadku braku działań niepożądanych) nawet w przypadku maksymalnego złagodzenia objawów.
Siła rekomendacji na poziomie A (poziom wiarygodności – 2).
Uwagi. Wynika to z faktu, że POChP jest chorobą postępującą, dlatego całkowita normalizacja parametrów czynności płuc nie jest możliwa.
U chorych na POChP bez nawracających zaostrzeń i z zachowaną funkcją płuc (FEV1 50% wartości należnej) zaleca się całkowite odstawienie ICS, pod warunkiem przepisania LABD.
Siła rekomendacji na poziomie B (poziom wiarygodności – 2).
Uwagi. Jeżeli w opinii lekarza pacjent nie potrzebuje kontynuować leczenia WKS lub w wyniku takiej terapii pojawiły się działania niepożądane, wówczas można odstawić ICS bez zwiększania ryzyka zaostrzeń.
U pacjentów z FEV1< 50% от должного, получающих тройную терапию, рекомендуется постепенная отмена ИГКС со ступенчатым уменьшением его дозы в течение 3 месяцев .
Siła rekomendacji: A (poziom wiarygodności – 3).
Uwagi. Wartość FEV1< 50% ранее считалось фактором риска частых обострений ХОБЛ и рассматривалось как показание к назначению комбинации ИГКС/ДДБА. В настоящее время такой подход не рекомендуется, поскольку он приводит к нежелательным эффектам и неоправданным затратам , хотя в реальной практике ИГКС и комбинации ИГКС/ДДБА назначаются неоправданно часто.
3.2 Leczenie chirurgiczne.
U chorych na POChP, u których występuje rozedma górnego płata płuc i niska tolerancja wysiłku, zaleca się operację zmniejszenia objętości płuc.Siła rekomendacji: C (poziom wiarygodności: 3).
Uwagi. Operację redukcji płuc przeprowadza się poprzez usunięcie części płuca w celu ograniczenia hiperinflacji i uzyskania bardziej wydajnego pompowania mięśni oddechowych. Obecnie w celu zmniejszenia objętości płuc można zastosować metody mniej inwazyjne – okluzję oskrzeli segmentowych za pomocą zastawek, specjalnego kleju itp.;
U szeregu chorych na bardzo ciężką POChP zaleca się przeszczepienie płuc, jeśli występują następujące wskazania: wskaźnik BODE ≥ 7 punktów (BODE – B – wskaźnik masy ciała, O – niedrożność (niedrożność), D – duszność (duszność) , E – tolerancja wysiłku (tolerancja wysiłku), FEV1< 15% от должных, ≥ 3 обострений в предшествующий год, 1 обострение с развитием острой гиперкапнической дыхательной недостаточности (ОДН), среднетяжелая-тяжелая легочная гипертензия (среднее давление в легочной артерии ≥35 мм) .
Siła rekomendacji: C (poziom wiarygodności: 3).
Uwagi. Przeszczep płuc może poprawić jakość życia i wyniki funkcjonalne u starannie wybranych pacjentów z POChP.
3.3 Inne zabiegi.
Długotrwała tlenoterapia.
Jednym z najpoważniejszych powikłań POChP, rozwijającym się w jej późnych (terminalnych) stadiach, jest przewlekła niewydolność oddechowa (CRF). Głównym objawem CDN jest rozwój hipoksemii itp.; zmniejszenie zawartości tlenu we krwi tętniczej (PaO2).VCT jest dziś jedną z niewielu metod terapii, które mogą zmniejszyć śmiertelność chorych na POChP. Hipoksemia nie tylko skraca życie chorych na POChP, ale ma także inne istotne niekorzystne konsekwencje: pogorszenie jakości życia, rozwój czerwienicy, zwiększone ryzyko wystąpienia zaburzeń rytmu serca podczas snu, rozwój i progresję nadciśnienia płucnego. VCT może zmniejszyć lub wyeliminować wszystkie te negatywne skutki hipoksemii.
U pacjentów z POChP i przewlekłą niewydolnością nerek zaleca się wykonanie VCT (wskazania, patrz Załącznik G8).
Siła rekomendacji na poziomie A (poziom wiarygodności – 1).
Uwagi. Należy podkreślić, że obecność klinicznych objawów serca płucnego sugeruje wcześniejsze wykonanie VCT.
Korekta hipoksemii tlenem jest najbardziej patofizjologiczną metodą leczenia przewlekłej niewydolności nerek. W odróżnieniu od szeregu stanów nagłych (zapalenie płuc, obrzęk płuc, uraz) stosowanie tlenu u pacjentów z przewlekłą hipoksemią musi być stałe, długotrwałe i z reguły prowadzone w domu, dlatego też ta forma terapii jest wskazana zwany VCT.
Zaleca się, aby parametry wymiany gazowej, na podstawie których opierają się wskazania do DCT, oceniać jedynie wtedy, gdy stan pacjenta jest stabilny itp.; 3-4 tygodnie po zaostrzeniu POChP.
Siła rekomendacji: C (poziom wiarygodności: 3).
Uwagi. Jest to dokładnie czas potrzebny na przywrócenie wymiany gazowej i transportu tlenu po okresie ARF. Przed przepisaniem VCT pacjentom z POChP zaleca się upewnić, że możliwości farmakoterapii zostały wyczerpane i maksymalna możliwa terapia nie prowadzi do wzrostu PaO2 powyżej wartości granicznych.
Przepisując tlenoterapię, zaleca się dążenie do osiągnięcia wartości PaO2 wynoszących 60 mm i SaO2 90%.
Siła rekomendacji: C (poziom wiarygodności: 3).
Nie zaleca się stosowania VCT u pacjentów z POChP, którzy nadal palą; osoby, które nie otrzymują odpowiedniej terapii lekowej mającej na celu kontrolę przebiegu POChP (leki rozszerzające oskrzela, ICS); niewystarczająco zmotywowani do tego typu terapii.
Siła rekomendacji: C (poziom wiarygodności: 3).
U większości chorych na POChP zaleca się wykonywanie VCT przez co najmniej 15 godzin dziennie, z maksymalnymi przerwami między sesjami nie dłuższymi niż 2 godziny z rzędu, przy przepływie tlenu 1–2 l/min.
Siła rekomendacji: B (poziom wiarygodności: 2).
Długotrwała wentylacja domu.
Hiperkapnia (td; zwiększone napięcie cząstkowe dwutlenku węgla we krwi tętniczej – PaCO2 ≥ 45 mm) jest markerem zmniejszonej rezerwy wentylacyjnej w terminalnych stadiach chorób płuc, a także stanowi negatywny czynnik prognostyczny u chorych na POChP. Nocna hiperkapnia zmienia wrażliwość ośrodka oddechowego na CO2, prowadząc do wzrostu stężenia PaCO2 w ciągu dnia, co ma negatywne konsekwencje dla pracy serca, mózgu i mięśni oddechowych. Dysfunkcja mięśni oddechowych w połączeniu z wysokim obciążeniem oporowym, elastycznym i progowym aparatu oddechowego dodatkowo pogłębia hiperkapnię u pacjentów z POChP, tworząc w ten sposób „błędne koło”, które można przerwać jedynie poprzez wspomaganie oddychania (wentylacja).U chorych na POChP ze stabilnym przebiegiem CDN, którzy nie wymagają intensywnej terapii, istnieje możliwość prowadzenia na bieżąco w domu długotrwałego wspomagania oddychania – tzw. długoterminowej wentylacji domowej (LHV).
Stosowaniu DDVL u chorych na POChP towarzyszy szereg pozytywnych efektów patofizjologicznych, z których głównymi są poprawa parametrów wymiany gazowej – wzrost PaO2 i spadek PaCO2, poprawa funkcji mięśni oddechowych, zwiększona tolerancja wysiłku, poprawa jakości snu i zmniejszenie wartości parametrów płucnych. nadciśnienie. Najnowsze badania wykazały, że przy odpowiednio dobranych parametrach wentylacji nieinwazyjnej (NIV) możliwa jest znacząca poprawa przeżycia chorych na POChP powikłaną przewlekłą niewydolnością oddechową z hiperkapnią.
DDVL zaleca się pacjentom z POChP, którzy spełniają następujące kryteria:
- Obecność objawów CDN: osłabienie, duszność, poranne bóle głowy;
- Obecność jednego z następujących wskaźników: PaCO2 55 mm, PaCO2 50-54 mm oraz epizody nocnych desaturacji (SaO2< 88% в течение более 5 мин во время O2-терапии 2 л/мин), PaCO2 50-54 мм и частые госпитализации вследствие развития повторных обострений (2 и более госпитализаций за 12 мес).
Siła zalecenia: A (poziom dowodu: 1).
5
1 Federalna Państwowa Instytucja Edukacyjna Budżetu Rosyjskiego Narodowego Uniwersytetu Medycznego im. NI Ministerstwo Zdrowia Rosji Pirogowa, Moskwa
2 Federalna Państwowa Instytucja Budżetowa „Instytut Badawczy Pulmonologii” FMBA Rosji, Moskwa
3 Federalna Państwowa Budżetowa Instytucja Edukacyjna Szkolnictwa Wyższego USMU Ministerstwa Zdrowia Rosji, Jekaterynburg
4 Federalna Państwowa Autonomiczna Instytucja Edukacyjna Szkolnictwa Wyższego Pierwszy Moskiewski Państwowy Uniwersytet Medyczny im. I. M. Sechenov Ministerstwo Zdrowia Rosji (Uniwersytet Sechenov), Moskwa
5 Federalna Państwowa Instytucja Budżetowa „CNIIT”, Moskwa
Do wyceny: Chuchalin A.G., Aisanov Z.R., Avdeev S.N., Leshchenko I.V., Ovcharenko S.I., Shmelev E.I. Federalne wytyczne kliniczne dotyczące diagnostyki i leczenia przewlekłej obturacyjnej choroby płuc // RMZh. 2014. Nr 5. s. 331
1. Metodologia
1. Metodologia
Metody stosowane w celu gromadzenia/wyboru materiału dowodowego:
. wyszukiwanie w elektronicznych bazach danych.
Opis metod stosowanych w celu gromadzenia/wyboru materiału dowodowego:
. Bazę dowodową rekomendacji stanowią publikacje znajdujące się w bazach Cochrane Library, EMBASE i MEDLINE. Głębokość poszukiwań wynosiła 5 lat.
Metody stosowane do oceny jakości i siły dowodów:
. konsensus ekspertów;
. ocena istotności zgodnie ze schematem ratingowym (tabela 1).
Metody stosowane do analizy dowodów:
. recenzje opublikowanych metaanaliz;
. przeglądy systematyczne z tabelami dowodowymi.
Opis metod zastosowanych do analizy materiału dowodowego.
Wybierając publikacje jako potencjalne źródła dowodów, metodologia zastosowana w każdym badaniu jest sprawdzana pod kątem jej wiarygodności. Wynik badania wpływa na poziom dowodów przypisanych publikacji, co z kolei wpływa na siłę powstałych rekomendacji.
Badanie metodologiczne opiera się na kilku kluczowych pytaniach, które koncentrują się na tych cechach projektu badania, które mają istotny wpływ na ważność wyników i wniosków. Te kluczowe pytania mogą się różnić w zależności od rodzaju badań i kwestionariuszy stosowanych w celu standaryzacji procesu oceny publikacji. W zaleceniach wykorzystano kwestionariusz MERGE opracowany przez Departament Zdrowia Nowej Południowej Walii. Kwestionariusz ten ma zostać szczegółowo oceniony i dostosowany do wymagań Rosyjskiego Towarzystwa Chorób Układu Oddechowego, aby zachować optymalną równowagę pomiędzy rygorem metodologicznym a praktycznym zastosowaniem.
Na proces oceny może oczywiście wpływać również czynnik subiektywny. Aby zminimalizować potencjalną stronniczość, każde badanie oceniano niezależnie, tj. przez co najmniej dwóch niezależnych członków grupy roboczej. Wszelkie różnice w ocenach były omawiane przez całą grupę jako całość. Jeżeli osiągnięcie konsensusu nie było możliwe, angażowano niezależnego eksperta.
Tabele dowodowe:
. tabele dowodowe zostały wypełnione przez członków grupy roboczej.
Metody stosowane przy formułowaniu rekomendacji:
. konsensus ekspertów.
Podstawowe zalecenia:
Siła rekomendacji (A-D), poziomy dowodów (1++, 1+, 1-, 2++, 2+, 2-, 3, 4) i wskaźniki dobrych praktyk (punkty dobrych praktyk) są podawane podczas prezentacji tekst zaleceń (tab. 1 i 2).
2. Definicja przewlekłej obturacyjnej choroby płuc (POChP) i epidemiologia
Definicja:
POChP jest chorobą charakteryzującą się upośledzeniem funkcji wentylacyjnej o charakterze obturacyjnym, częściowo odwracalnym, która zwykle postępuje i wiąże się ze zwiększoną przewlekłą odpowiedzią zapalną płuc na działanie patogennych cząstek lub gazów. U niektórych pacjentów zaostrzenia i choroby współistniejące mogą wpływać na ogólne nasilenie POChP.
Tradycyjnie POChP łączy w sobie przewlekłe zapalenie oskrzeli i rozedmę płuc.
Przewlekłe zapalenie oskrzeli jest zwykle definiowane klinicznie jako obecność plwociny powodującej kaszel przez co najmniej 3 miesiące. przez następne 2 lata. Rozedmę płuc definiuje się morfologicznie jako obecność trwałego poszerzenia dróg oddechowych dystalnie od oskrzelików końcowych, związanego z zniszczeniem ścian pęcherzyków płucnych, niezwiązanego ze zwłóknieniem. U chorych na POChP najczęściej występują oba schorzenia i klinicznie trudno je rozróżnić.
Pojęcie POChP nie obejmuje astmy oskrzelowej (BA) i innych chorób związanych ze słabo odwracalną obturacją oskrzeli (mukowiscydoza, rozstrzenie oskrzeli, zarostowe zapalenie oskrzelików).
Epidemiologia
Rozpowszechnienie
POChP jest obecnie problemem globalnym. W niektórych krajach świata częstość występowania POChP jest bardzo wysoka (ponad 20% w Chile), w innych mniejsza (około 6% w Meksyku). Przyczyną tej zmienności są różnice w stylu życia, zachowaniu i narażeniu ludzi na różnorodne szkodliwe czynniki.
Jedno globalne badanie (projekt BOLD) dało wyjątkową okazję do oszacowania częstości występowania POChP przy użyciu standardowych kwestionariuszy i testów czynnościowych płuc w populacjach dorosłych powyżej 40. roku życia, zarówno w krajach rozwiniętych, jak i rozwijających się. Częstość występowania POChP w stopniu II i wyższym (GOLD 2008) według badania BOLD wśród osób po 40. roku życia wynosiła 10,1±4,8%, w tym wśród mężczyzn – 11,8±7,9%, a wśród kobiet – 8,5±5,8%. Według badania epidemiologicznego dotyczącego częstości występowania POChP w regionie Samara (mieszkańcy w wieku 30 lat i starsi) częstość występowania POChP w całej próbie wyniosła 14,5% (wśród mężczyzn – 18,7%, wśród kobiet – 11,2%). Według wyników innego rosyjskiego badania przeprowadzonego w obwodzie irkuckim częstość występowania POChP u osób powyżej 18. roku życia wśród ludności miejskiej wynosiła 3,1%, a wśród ludności wiejskiej – 6,6%. Częstość występowania POChP wzrasta wraz z wiekiem: w grupie wiekowej od 50 do 69 lat na tę chorobę chorowało 10,1% mężczyzn w miastach i 22,6% na wsi. Niemal co drugi mężczyzna po 70. roku życia mieszkający na wsi rozpoznał POChP.
Śmiertelność
Według WHO POChP jest obecnie czwartą najczęstszą przyczyną zgonów na świecie. Co roku na POChP umiera około 2,75 miliona osób, co stanowi 4,8% wszystkich przyczyn zgonów. W Europie śmiertelność z powodu POChP jest bardzo zróżnicowana: od 0,2 na 100 tys. mieszkańców w Grecji, Szwecji, Islandii i Norwegii do 80 na 100 tys. na Ukrainie i w Rumunii.
W latach 1990-2000 śmiertelność z powodu chorób układu krążenia (CVD) i udaru mózgu spadła odpowiednio o 19,9% i 6,9%, podczas gdy śmiertelność z powodu POChP wzrosła o 25,5%. Szczególnie wyraźny wzrost umieralności z powodu POChP obserwuje się wśród kobiet.
Do czynników predykcyjnych śmiertelności u chorych na POChP zalicza się takie czynniki, jak stopień obturacji oskrzeli, stan odżywienia (wskaźnik masy ciała (BMI)), wytrzymałość fizyczna w teście 6-minutowego marszu oraz nasilenie duszności, częstotliwość i nasilenie zaostrzeń i nadciśnienie płucne.
Głównymi przyczynami zgonów chorych na POChP są niewydolność oddechowa (RF), rak płuc, choroby układu krążenia oraz nowotwory o innej lokalizacji.
Społeczno-ekonomiczne znaczenie POChP
W krajach rozwiniętych całkowite koszty ekonomiczne związane z POChP w strukturze chorób płuc zajmują 2. miejsce po raku płuca i 1. miejsce w kosztach bezpośrednich, przewyższając 1,9-krotnie bezpośrednie koszty astmy. Koszty ekonomiczne na pacjenta związanego z POChP są 3 razy wyższe niż w przypadku pacjenta chorego na astmę. Z nielicznych raportów na temat bezpośrednich kosztów leczenia POChP wynika, że na opiekę szpitalną przeznacza się ponad 80% środków finansowych, a na opiekę ambulatoryjną niecałe 20%. Stwierdzono, że 73% kosztów przypada na 10% pacjentów z ciężką chorobą. Największe szkody ekonomiczne wiąże się z leczeniem zaostrzeń POChP. W Rosji obciążenie ekonomiczne POChP, biorąc pod uwagę koszty pośrednie, w tym absencję (absencję) i prezenteizm (mniejsza efektywność pracy ze względu na zły stan zdrowia), wynosi 24,1 miliarda rubli.
3. Obraz kliniczny POChP
W warunkach narażenia na czynniki ryzyka (palenie tytoniu czynne i bierne, zanieczyszczenia egzogenne, paliwo bioorganiczne itp.) POChP zwykle rozwija się powoli i postępuje stopniowo. Osobliwością obrazu klinicznego jest to, że przez długi czas choroba postępuje bez wyraźnych objawów klinicznych (3, 4; D).
Pierwszymi objawami, z którymi pacjenci zgłaszają się do lekarza, jest kaszel, często z odkrztuszaniem plwociny i/lub duszność. Objawy te są najbardziej widoczne rano. W zimnych porach roku występują „częste przeziębienia”. Oto obraz kliniczny początku choroby.
Przewlekły kaszel, będący zwykle pierwszym objawem POChP, jest często bagatelizowany przez pacjentów i lekarzy, gdyż uważa się go za spodziewaną konsekwencję palenia i/lub narażenia na niekorzystne czynniki środowiskowe. Pacjenci zwykle wytwarzają niewielką ilość lepkiej plwociny. Zwiększony kaszel i plwocina występuje najczęściej w miesiącach zimowych, podczas zaostrzeń infekcyjnych.
Duszność jest najważniejszym objawem POChP (4; D). Często jest powodem poszukiwania pomocy lekarskiej i główną przyczyną ograniczenia aktywności zawodowej pacjenta. Wpływ duszności na zdrowie ocenia się za pomocą kwestionariusza British Medical Research Council (mMRC). Początkowo duszność pojawia się przy stosunkowo dużej aktywności fizycznej, takiej jak bieganie po równym podłożu lub wchodzenie po schodach. W miarę postępu choroby duszność nasila się i może ograniczać nawet codzienną aktywność, a później pojawia się w spoczynku, zmuszając pacjenta do pozostania w domu (tab. 3). Ponadto ocena duszności w skali mMRC jest czułym narzędziem przewidywania przeżycia u chorych na POChP.
Opisując obraz kliniczny POChP, należy wziąć pod uwagę cechy charakterystyczne tej choroby: subkliniczny początek, brak specyficznych objawów oraz stały postęp choroby.
Nasilenie objawów różni się w zależności od fazy choroby (przebieg stabilny lub zaostrzenie). Stan, w którym nasilenie objawów nie zmienia się znacząco na przestrzeni tygodni, a nawet miesięcy, należy uznać za stabilny, a w tym przypadku postęp choroby można wykryć jedynie długoterminową (6-12 miesięcy) dynamiczną obserwacją stanu chorobowego. pacjent.
Szczególny wpływ na obraz kliniczny mają zaostrzenia choroby - okresowo występujące pogorszenie stanu zdrowia (trwające co najmniej 2-3 dni), któremu towarzyszy wzrost nasilenia objawów i zaburzeń czynnościowych. W czasie zaostrzenia dochodzi do nasilenia hiperinflacji i tzw. „pułapek powietrznych” w połączeniu ze zmniejszonym przepływem wydechowym, co prowadzi do wzmożonej duszności, której zwykle towarzyszy pojawienie się lub nasilenie odległego świszczącego oddechu, uczucie ucisku w klatce piersiowej i zmniejszenie tolerancji wysiłku. Ponadto zwiększa się intensywność kaszlu, ilość plwociny, charakter jej separacji, zmienia się kolor i lepkość (wzrost lub gwałtowny spadek). Jednocześnie pogarszają się wskaźniki funkcji oddychania zewnętrznego (FER) i gazów krwi: zmniejszają się wskaźniki prędkości (wymuszona objętość wydechowa w ciągu 1 s (FEV1) itp.), Może wystąpić hipoksemia, a nawet hiperkapnia. Zaostrzenia mogą rozpoczynać się stopniowo, stopniowo lub mogą charakteryzować się szybkim pogorszeniem stanu pacjenta wraz z rozwojem ostrej niewydolności oddechowej i rzadziej niewydolności prawej komory.
Przebieg POChP to naprzemienna faza stabilna i zaostrzenie choroby, ale różni się ona w zależności od osoby. Jednakże postęp POChP jest częsty, zwłaszcza jeśli pacjent w dalszym ciągu jest narażony na wdychane cząstki chorobotwórcze lub gazy. Obraz kliniczny choroby zależy również w dużym stopniu od fenotypu choroby i odwrotnie, fenotyp determinuje charakterystykę objawów klinicznych POChP. Od wielu lat istnieje podział chorych na fenotypy rozedmowe i oskrzelowe.
Typ zapalenia oskrzeli charakteryzuje się przewagą objawów zapalenia oskrzeli (kaszel, wytwarzanie plwociny). Rozedma płuc w tym przypadku jest mniej wyraźna. Przeciwnie, w typie rozedmowym rozedma płuc jest głównym objawem patologicznym, duszność przeważa nad kaszlem. Jednak w praktyce klinicznej bardzo rzadko można wyodrębnić fenotyp POChP z rozedmą lub zapaleniem oskrzeli w tak zwanej „czystej” postaci (właściwiej byłoby mówić o fenotypie choroby z przewagą zapalenia oskrzeli lub z przewagą rozedmy). Cechy fenotypów przedstawiono bardziej szczegółowo w tabeli 4.
Jeżeli nie da się rozróżnić przewagi jednego lub drugiego fenotypu, należy mówić o fenotypie mieszanym. W warunkach klinicznych częściej występują pacjenci z mieszanym typem choroby.
Oprócz powyższego obecnie identyfikuje się inne fenotypy choroby. Przede wszystkim dotyczy to tzw. fenotypu nakładania się (połączenie POChP i astmy). Konieczne jest dokładne różnicowanie chorych na POChP i astmę. Jednak pomimo znaczących różnic w przebiegu przewlekłego stanu zapalnego w tych chorobach, u niektórych pacjentów POChP i astma mogą występować jednocześnie. Fenotyp ten może rozwinąć się u palących pacjentów cierpiących na astmę. Jednocześnie w wyniku szeroko zakrojonych badań wykazano, że u około 20–30% chorych na POChP może występować odwracalna obturacja oskrzeli, a podczas stanu zapalnego w składzie komórkowym pojawiają się eozynofile. Niektórych z tych pacjentów można również przypisać fenotypowi „POChP + BA”. Tacy pacjenci dobrze reagują na terapię kortykosteroidami.
Innym fenotypem, o którym ostatnio się mówi, są pacjenci z częstymi zaostrzeniami (2 lub więcej zaostrzeń w ciągu roku lub 1 lub więcej zaostrzeń prowadzących do hospitalizacji). O znaczeniu tego fenotypu decyduje fakt, że pacjent wychodzi z zaostrzenia ze zmniejszonymi wskaźnikami czynnościowymi płuc, a częstotliwość zaostrzeń bezpośrednio wpływa na długość życia pacjentów, wymagane jest indywidualne podejście do leczenia; Identyfikacja wielu innych fenotypów wymaga dalszych wyjaśnień. W kilku ostatnich badaniach zwrócono uwagę na różnice w obrazie klinicznym POChP u mężczyzn i kobiet. Jak się okazało, kobiety charakteryzują się wyraźniejszą nadreaktywnością dróg oddechowych, odnotowują wyraźniejszą duszność przy tym samym poziomie niedrożności oskrzeli jak u mężczyzn itp. Przy tych samych wskaźnikach funkcjonalnych dotlenienie przebiega lepiej u kobiet niż u mężczyzn mężczyźni. Kobiety jednak częściej zapadają na zaostrzenia, wykazują mniejszą skuteczność ćwiczeń fizycznych w programach rehabilitacyjnych i gorzej oceniają swoją jakość życia (QoL) według standardowych kwestionariuszy.
Powszechnie wiadomo, że u pacjentów z POChP występują liczne pozapłucne objawy choroby, spowodowane ogólnoustrojowym działaniem przewlekłego stanu zapalnego charakterystycznego dla POChP. Dotyczy to przede wszystkim dysfunkcji obwodowych mięśni szkieletowych, co w istotny sposób przyczynia się do obniżonej tolerancji wysiłku. Przewlekły, uporczywy stan zapalny odgrywa ważną rolę w uszkodzeniu śródbłonka naczyń i rozwoju miażdżycy u pacjentów z POChP, co z kolei przyczynia się do rozwoju chorób sercowo-naczyniowych (nadciśnienia tętniczego (AH), choroby niedokrwiennej serca (CHD), ostrego zawału mięśnia sercowego ( AMI), niewydolność serca (HF)) u pacjentów z POChP i zwiększa ryzyko zgonu. Zmiany w stanie odżywienia są wyraźnie widoczne. Z kolei obniżony stan odżywienia może stanowić niezależny czynnik ryzyka zgonu pacjentów. Do rozwoju osteoporozy przyczynia się także ogólnoustrojowy stan zapalny. U pacjentów cierpiących na POChP objawy osteoporozy są wyraźniejsze w porównaniu z osobami, które nie chorują na POChP w tej samej grupie wiekowej. Ostatnio zwrócono uwagę na fakt, że u chorych na POChP oprócz czerwienicy w 10–20% przypadków występuje niedokrwistość. Jej przyczyna nie jest do końca poznana, ale istnieją podstawy, by sądzić, że jest ona skutkiem ogólnoustrojowego efektu przewlekłego stanu zapalnego w POChP.
Istotny wpływ na obraz kliniczny choroby mają zaburzenia neuropsychiatryczne, objawiające się utratą pamięci, depresją, pojawieniem się „lęków” i zaburzeniami snu.
Pacjenci z POChP charakteryzują się częstym rozwojem chorób współistniejących, które występują u starszych pacjentów niezależnie od obecności POChP, ale z jej obecnością - z większym prawdopodobieństwem (choroba wieńcowa, nadciśnienie, miażdżyca naczyń kończyn dolnych itp.). . Inne choroby współistniejące (cukrzyca, choroba refluksowa przełyku, gruczolak prostaty, zapalenie stawów) mogą współistnieć z POChP, ponieważ są częścią procesu starzenia i mają istotny wpływ na obraz kliniczny pacjenta chorego na POChP.
W trakcie naturalnego rozwoju POChP obraz kliniczny może się zmieniać ze względu na pojawiające się powikłania choroby: zapalenie płuc, odmę opłucnową, ostrą DN (AP), zatorowość płucną (PE), rozstrzenie oskrzeli, krwotok płucny, rozwój serca płucnego i jego dekompensację z ciężką niewydolnością krążenia.
Podsumowując opis obrazu klinicznego, należy podkreślić, że nasilenie objawów klinicznych choroby zależy od wielu z powyższych czynników. Wszystko to, wraz z intensywnością narażenia na czynniki ryzyka i tempem postępu choroby, tworzy wygląd pacjenta w różnych okresach jego życia.
4. Zasady diagnostyczne
Aby prawidłowo zdiagnozować POChP, należy przede wszystkim oprzeć się na kluczowych (podstawowych) zapisach wynikających z definicji choroby. U wszystkich pacjentów, u których występuje kaszel, odkrztuszanie plwociny lub duszność i gdy zidentyfikowano czynniki ryzyka POChP, należy rozważyć rozpoznanie POChP. W prawdziwym życiu palacz we wczesnych stadiach choroby nie uważa się za chorego, ponieważ kaszel uważa za stan normalny, jeśli jego aktywność zawodowa nie została jeszcze zakłócona. Nawet pojawienie się duszności występującej podczas aktywności fizycznej jest przez niego traktowane jako skutek starości lub przetrenowania.
Kluczowym czynnikiem anamnestycznym pomagającym w ustaleniu rozpoznania POChP jest ustalenie faktu narażenia układu oddechowego na działanie czynników chorobotwórczych, przede wszystkim dymu tytoniowego, poprzez wdychanie. Przy ocenie statusu palenia zawsze podaje się wskaźnik osoby palącej (pako-lata). Podczas zbierania wywiadu dużą uwagę należy zwrócić także na identyfikację epizodów biernego palenia. Dotyczy to wszystkich grup wiekowych, także narażenia płodu na dym tytoniowy w okresie prenatalnym w wyniku palenia przez samą ciężarną lub osoby z jej otoczenia. Za czynniki prowadzące do zachorowania na POChP uważa się narażenie zawodowe na wdychanie, a także palenie tytoniu. Dotyczy to różnych form zanieczyszczeń powietrza w miejscu pracy, w tym gazów i aerozoli, a także narażenia na dym z paliw kopalnych.
Dlatego diagnostyka POChP powinna uwzględniać następujące obszary:
- identyfikacja czynników ryzyka;
- obiektywizacja objawów niedrożności;
- monitorowanie czynności oddechowej płuc.
Wynika z tego, że rozpoznanie POChP opiera się na analizie szeregu etapów:
- stworzenie werbalnego portretu pacjenta na podstawie informacji uzyskanych z rozmowy z nim (dokładne zebranie wywiadu);
- badanie obiektywne (fizyczne);
- wyniki badań laboratoryjnych i instrumentalnych. Rozpoznanie POChP należy zawsze potwierdzić za pomocą spirometrii. Wartości FEV1/nasilonej pojemności życiowej (FVC) po rozszerzeniu oskrzeli<70% - обязательный признак ХОБЛ, который существует на всех стадиях заболевания.
Ze względu na to, że POChP nie ma specyficznych objawów, a kryterium rozpoznania jest wskaźnik spirometryczny, choroba może przez długi czas pozostać nierozpoznana. Problem niezdiagnozowania wynika także z faktu, że wiele osób cierpiących na POChP nie odczuwa mdłości z powodu braku duszności na pewnym etapie choroby i nie zwraca na to uwagi lekarza. Wynika z tego, że w zdecydowanej większości przypadków rozpoznanie POChP stawia się w niepełnosprawnym stadium choroby.
Szczegółowa rozmowa z każdym palącym pacjentem przyczyni się do wczesnego wykrycia choroby, ponieważ przy aktywnym zadawania pytań i braku skarg można zidentyfikować objawy charakterystyczne dla rozwoju przewlekłego stanu zapalnego w drzewie oskrzelowym, przede wszystkim kaszel.
Podczas rozmowy z pacjentem można wykorzystać kwestionariusz pozwalający zdiagnozować POChP* (tab. 5).
W procesie powstawania nieodwracalnych zmian w drzewie oskrzelowym i miąższu płuc pojawia się duszność (w rozmowie z pacjentem należy ocenić jej nasilenie, związek z aktywnością fizyczną itp.).
We wczesnych stadiach choroby (jeśli z jakiegoś powodu pacjent nadal zwraca się w tym czasie do lekarza) badanie nie ujawnia żadnych nieprawidłowości charakterystycznych dla POChP, jednak brak objawów klinicznych nie wyklucza jej obecności . Wraz ze wzrostem rozedmy płuc i nieodwracalnym składnikiem niedrożności oskrzeli, wydech może nastąpić przez szczelnie zamknięte lub złożone usta, co wskazuje na wyraźne zapadnięcie wydechowe małych oskrzeli i spowolnienie przepływu wydychanego powietrza, co łagodzi stan pacjentów. Innymi objawami hiperinflacji może być beczkowata klatka piersiowa, poziome ułożenie żeber i zmniejszona otępienie serca.
Włączenie mięśni Scalenae i Sternocleidomastoideus do aktu oddychania jest wskaźnikiem dalszego pogorszenia naruszenia mechaniki oddechowej i zwiększonego obciążenia aparatu oddechowego. Kolejnym objawem może być paradoksalny ruch przedniej ściany jamy brzusznej - jej cofanie się podczas wdechu, co świadczy o zmęczeniu przepony. Spłaszczenie przepony prowadzi do cofania się dolnych żeber podczas wdechu (objaw Hoovera) i poszerzenia kąta kifosternego. Kiedy mięśnie oddechowe są przemęczone, często pojawia się hiperkapnia, która wymaga odpowiedniej oceny.
Podczas badania fizykalnego pacjentów można zobiektywizować obecność niedrożności oskrzeli, słuchając suchego świszczącego oddechu, a podczas opukiwania pudełkowaty dźwięk perkusji potwierdza obecność hiperinflacji.
Wśród laboratoryjnych metod diagnostycznych do obowiązkowych badań zalicza się kliniczne badanie krwi i badanie cytologiczne plwociny. W przypadku ciężkiej rozedmy płuc i u młodego pacjenta należy oznaczyć α1-antytrypsynę. Podczas zaostrzenia choroby najczęściej występuje leukocytoza neutrofilowa z przesunięciem pasma i wzrostem ESR. Obecność leukocytozy stanowi dodatkowy argument przemawiający za czynnikiem zakaźnym jako przyczyną zaostrzenia POChP. Można wykryć zarówno niedokrwistość (wynik ogólnego zespołu zapalnego), jak i czerwienicę. Zespół policytemii (zwiększona liczba czerwonych krwinek, wysoki poziom hemoglobiny -
>16 g/dl u kobiet i >18 g/dl u mężczyzn, podwyższony hematokryt >47% u kobiet i >52% u mężczyzn) może wskazywać na istnienie ciężkiej i długotrwałej hipoksemii.
Badanie cytologiczne plwociny dostarcza informacji o charakterze procesu zapalnego i stopniu jego nasilenia. Wykrycie komórek atypowych zwiększa podejrzenie nowotworu i wymaga zastosowania dodatkowych metod badawczych.
W przypadku niekontrolowanego postępu procesu infekcyjnego wskazane jest wykonanie posiewowego badania mikrobiologicznego plwociny i na tej podstawie dobranie racjonalnej antybiotykoterapii. W tym samym celu przeprowadza się badanie bakteriologiczne zawartości oskrzeli uzyskanej podczas bronchoskopii.
U wszystkich pacjentów z podejrzeniem POChP należy wykonać radiogram klatki piersiowej. Metoda ta nie jest czułym narzędziem diagnostycznym, ale pozwala wykluczyć inne choroby, którym towarzyszą podobne objawy kliniczne (guz, gruźlica, zastoinowa niewydolność serca itp.), a w czasie zaostrzenia wykryć zapalenie płuc, wysięk opłucnowy. , samoistna odma opłucnowa itp. Ponadto można zidentyfikować następujące radiologiczne objawy niedrożności oskrzeli: spłaszczenie kopuły i ograniczenie ruchomości przepony podczas ruchów oddechowych, zmiany w przednio-tylnym rozmiarze jamy klatki piersiowej, poszerzenie tętnicy zamostkowej przestrzeń, pionowe położenie serca.
Badanie bronchoskopowe stanowi dodatkową metodę diagnozowania POChP, pozwalającą wykluczyć inne choroby i stany, które występują z podobnymi objawami.
Elektrokardiografię i echokardiografię wykonuje się w celu wykluczenia kardiologicznego pochodzenia objawów ze strony układu oddechowego oraz identyfikacji cech przerostu prawego serca.
U wszystkich pacjentów z podejrzeniem POChP należy wykonać spirometrię.
5. Funkcjonalne testy diagnostyczne
monitorowanie przebiegu POChP
Spirometria jest główną metodą diagnozowania i dokumentowania zmian w czynności płuc w POChP. Klasyfikacja POChP ze względu na nasilenie obturacyjnych zaburzeń wentylacji opiera się na wskaźnikach spirometrycznych. Pozwala wykluczyć inne choroby o podobnych objawach.
Spirometria jest preferowanym badaniem wstępnym pozwalającym ocenić obecność i nasilenie niedrożności dróg oddechowych.
Metodologia
. Istnieją różne zalecenia dotyczące stosowania spirometrii jako metody diagnozowania i określania ciężkości obturacyjnych chorób płuc.
. Badanie czynności płuc za pomocą wymuszonej spirometrii można uznać za zakończone, jeśli uzyska się 3 technicznie dopuszczalne manewry oddechowe. Jednocześnie wyniki muszą być powtarzalne: maksymalne i kolejne wskaźniki FVC, a także maksymalne i kolejne wskaźniki FEV1 powinny różnić się nie więcej niż 150 ml. W przypadkach, gdy wartość FVC nie przekracza 1000 ml, maksymalna dopuszczalna różnica zarówno FVC, jak i FEV1 nie powinna przekraczać 100 ml.
. Jeżeli po 3 próbach nie uzyska się powtarzalnych wyników, manewry oddechowe należy kontynuować do 8 prób. Większa liczba manewrów oddechowych może skutkować zmęczeniem pacjenta i, w rzadkich przypadkach, zmniejszeniem FEV1 lub FVC.
. Jeżeli w wyniku powtarzających się wymuszonych manewrów wskaźniki spadną o więcej niż 20% od wartości początkowej, w trosce o bezpieczeństwo pacjenta należy przerwać dalsze badania, a dynamikę wskaźników należy odzwierciedlić w raporcie. W raporcie należy przedstawić wyniki graficzne i wartości liczbowe przynajmniej 3 najlepszych prób.
. Wyniki prób technicznie dopuszczalnych, które nie spełniają kryterium powtarzalności, mogą posłużyć do napisania wniosku wskazującego, że nie są one powtarzalne.
Objawy spirometryczne POChP
Podczas wykonywania spirometrii POChP objawia się ograniczeniem przepływu wydechowego powietrza na skutek zwiększonego oporu w drogach oddechowych (ryc. 1).
Obturacyjny typ zaburzeń wentylacji charakteryzuje się spadkiem stosunku wskaźników FEV1/FVC<0,7.
W części wydechowej krzywej przepływ-objętość występuje zagłębienie, a jej ramię zstępujące przyjmuje kształt wklęsły. Charakterystyczną cechą zaburzeń wentylacji obturacyjnej jest zaburzenie liniowości dolnej połowy krzywej przepływ-objętość, nawet gdy stosunek FEV1/FVC > 0,7. Nasilenie zmian zależy od nasilenia zaburzeń obturacyjnych.
W miarę postępu obturacji oskrzeli następuje dalsze zmniejszenie przepływu wydechowego, zwiększenie „pułapek powietrznych” i hiperinflacja płuc, co prowadzi do spadku wskaźników FVC. Aby wykluczyć mieszane zaburzenia obturacyjno-restrykcyjne, należy zmierzyć całkowitą pojemność płuc (TLC) za pomocą pletyzmografii ciała.
Aby ocenić stopień zaawansowania rozedmy płuc, należy wykonać badanie TLC i dyfuzyjnego DSL.
Test odwracalności (test leku rozszerzającego oskrzela)
Jeżeli podczas wstępnego badania spirometrycznego zostaną stwierdzone objawy obturacji oskrzeli, wskazane jest wykonanie badania odwracalności (badanie na lek rozszerzający oskrzela) w celu określenia stopnia odwracalności obturacji pod wpływem leków rozszerzających oskrzela.
W celu zbadania odwracalności niedrożności wykonuje się badania z wziewnymi lekami rozszerzającymi oskrzela, ocenia się ich wpływ na FEV1. Nie zaleca się stosowania innych wskaźników krzywej przepływ-objętość, które głównie wyprowadza się i oblicza na podstawie FVC.
Metodologia
. Podczas wykonywania badania zaleca się stosowanie krótko działających leków rozszerzających oskrzela w maksymalnej jednorazowej dawce:
- dla β2-agonistów – salbutamol 400 mcg;
- w przypadku leków antycholinergicznych - bromek ipratropium 160 mcg.
. W niektórych przypadkach możliwe jest zastosowanie kombinacji leków antycholinergicznych i krótko działających β2-agonistów we wskazanych dawkach. Inhalatory aerozolowe z odmierzoną dawką muszą być używane ze spejserem.
. Ponowne badanie spirometryczne należy wykonać po 15 minutach. po inhalacji
β2-agonistów lub po 30-45 min. po wdychaniu leków antycholinergicznych lub ich połączeniu z
β2-agoniści.
Kryteria pozytywnej odpowiedzi
Test na lek rozszerzający oskrzela uznaje się za pozytywny, jeżeli po inhalacji leku rozszerzającego oskrzela współczynnik rozszerzenia oskrzeli (CBD) osiąga lub przekracza 12%, a bezwzględny wzrost wynosi 200 ml lub więcej:
CBD = (FEV1 post (ml) - FEV1 surowy (ml)/FEV1 surowy (ml)) x 100%
Wzrost bezwzględny (ml) = FEV1 po (ml) - FEV1 na zewnątrz. (ml),
gdzie FEV1 ref. - wartość wskaźnika spirometrycznego przed inhalacją leku rozszerzającego oskrzela, FEV1 po - wartość wskaźnika po inhalacji leku rozszerzającego oskrzela.
Aby uzyskać pozytywny wynik testu na działanie leku rozszerzającego oskrzela, muszą zostać spełnione oba kryteria.
Oceniając badanie rozszerzające oskrzela, należy wziąć pod uwagę działania niepożądane ze strony układu sercowo-naczyniowego: tachykardię, zaburzenia rytmu, podwyższone ciśnienie krwi, a także pojawienie się objawów, takich jak pobudzenie czy drżenie.
Techniczną zmienność wyników spirometrii można zminimalizować dzięki regularnej kalibracji sprzętu, dokładnemu instruowaniu pacjenta i zaawansowanemu szkoleniu personelu.
Właściwe wartości
Właściwe wartości zależą od parametrów antropometrycznych, głównie wzrostu, płci, wieku, rasy. Należy jednak wziąć pod uwagę indywidualne różnice w normie. Zatem u osób z początkowymi wskaźnikami powyżej średniego poziomu, wraz z rozwojem patologii płuc, wskaźniki te zmniejszą się w stosunku do początkowych, ale nadal mogą pozostać w normie populacyjnej.
Monitoring (badania seryjne)
Monitorowanie parametrów spirometrycznych (FEV1 i FVC) rzetelnie odzwierciedla dynamikę zmian czynności płuc podczas obserwacji długoterminowej, należy jednak uwzględnić prawdopodobieństwo technicznej i biologicznej zmienności wyników.
U osób zdrowych zmiany FVC i FEV1 uważa się za istotne klinicznie, jeśli w powtarzanych badaniach w ciągu 1 dnia różnica przekracza 5%, w ciągu kilku tygodni - 12%.
Zwiększone tempo pogorszenia się czynności płuc (ponad 40 ml/rok) nie jest obowiązkowym objawem POChP. Ponadto nie można tego potwierdzić indywidualnie, gdyż dopuszczalny poziom zmienności FEV1 w obrębie jednego badania znacznie przekracza tę wartość i wynosi 150 ml.
Monitorowanie szczytowego przepływu wydechowego (PEF).
PEF stosuje się w celu wykluczenia zwiększonej zmienności dobowej, która jest bardziej charakterystyczna dla astmy i odpowiedzi na leczenie farmakologiczne.
Najlepszy wskaźnik odnotowano po 3 próbach wykonania manewru wymuszonego z przerwą nie dłuższą niż 2 s po inhalacji. Manewr wykonywany jest w pozycji siedzącej lub stojącej. Więcej pomiarów wykonuje się, jeśli różnica pomiędzy 2 maksymalnymi wartościami PEF przekracza 40 l/min.
PEF służy do oceny zmienności przepływu powietrza na podstawie wielu pomiarów wykonywanych w ciągu co najmniej 2 tygodni. Zwiększoną zmienność można zarejestrować przy podwójnych pomiarach w ciągu 1 dnia. Częstsze pomiary poprawiają wynik. Zwiększenie dokładności pomiaru w tym przypadku osiąga się zwłaszcza u pacjentów z obniżoną podatnością.
Zmienność PEF najlepiej obliczyć jako różnicę między wartościami maksymalnymi i minimalnymi jako procent średniego lub maksymalnego dziennego PEF.
Górna granica normalnych wartości dla odchyleń od wartości maksymalnej wynosi około 20%, jeśli w ciągu 1 dnia wykonano 4 lub więcej pomiarów. Jednakże może być niższa w przypadku stosowania podwójnych pomiarów.
Zmienność PEF może być zwiększona w przypadku chorób, w przypadku których najczęściej przeprowadza się diagnostykę różnicową astmy. Dlatego w praktyce klinicznej poziom swoistości zwiększonej zmienności PEF jest niższy niż w badaniach populacyjnych.
Wartości PEF należy interpretować biorąc pod uwagę sytuację kliniczną. Badanie PEF ma zastosowanie wyłącznie do monitorowania pacjentów z ustalonym rozpoznaniem POChP.
6. Diagnostyka różnicowa POChP
Głównym zadaniem diagnostyki różnicowej POChP jest wykluczenie chorób o podobnych objawach. Pomimo bardzo wyraźnych różnic między astmą i POChP pod względem mechanizmów rozwoju, objawów klinicznych oraz zasad zapobiegania i leczenia, te dwie choroby mają pewne cechy wspólne. Ponadto możliwe jest połączenie tych chorób u jednej osoby.
Diagnostyka różnicowa BA i POChP opiera się na integracji podstawowych danych klinicznych, wyników badań funkcjonalnych i laboratoryjnych. Cechy stanu zapalnego w POChP i astmie przedstawiono na rycinie 2.
Wiodące punkty wyjścia do diagnostyki różnicowej tych chorób przedstawiono w tabeli 6.
Na pewnych etapach rozwoju POChP, zwłaszcza już na pierwszym spotkaniu z pacjentem, istnieje potrzeba odróżnienia jej od szeregu chorób o podobnych objawach. Ich główne cechy wyróżniające podano w tabeli 7.
Diagnostyka różnicowa na różnych etapach rozwoju POChP ma swoją własną charakterystykę. W łagodnych przypadkach POChP najważniejsze jest rozpoznanie różnic od innych chorób związanych z czynnikami agresji środowiskowej, występującymi subklinicznie lub z niewielkimi objawami. Przede wszystkim dotyczy to różnych wariantów przewlekłego zapalenia oskrzeli. Trudności pojawiają się przy diagnostyce różnicowej u pacjentów z ciężką POChP. Decyduje o tym nie tylko ciężkość stanu pacjenta, nasilenie nieodwracalnych zmian, ale także duży zestaw chorób współistniejących (choroba niedokrwienna serca, nadciśnienie, choroby metaboliczne itp.).
7. Współczesna klasyfikacja POChP.
Kompleksowa ocena ciężkości choroby
Klasyfikacja POChP (tab. 8) w ostatnich latach opiera się na wskaźnikach stanu funkcjonalnego płuc, na podstawie wartości FEV1 po zastosowaniu leku rozszerzającego oskrzela, wyróżnia 4 etapy choroby;
Komisja Ekspertów GOLD 2011 zrezygnowała z określenia „stadia”, gdyż wskaźnik ten opiera się wyłącznie na wartości FEV1 i nie jest adekwatny do scharakteryzowania ciężkości choroby. Ostatnie badania wykazały, że nie we wszystkich przypadkach choroby występuje stopień zaawansowania. Nie ma dowodów na rzeczywiste istnienie etapów POChP (przejście z jednego etapu do drugiego przy zastosowaniu nowoczesnej terapii). Jednocześnie wartości FEV1 pozostają istotne, ponieważ odzwierciedlają stopień (od łagodnego - odpowiednio I stopnia do skrajnie ciężkiego - etapu IV) nasilenia ograniczenia przepływu powietrza. Wykorzystuje się je w kompleksowej ocenie ciężkości przebiegu POChP.
W rewizji dokumentu GOLD z 2011 roku zaproponowano nową klasyfikację opartą na zintegrowanej ocenie ciężkości pacjentów z POChP. Uwzględnia nie tylko nasilenie obturacji oskrzeli (stopień upośledzenia obturacji oskrzeli) zgodnie z wynikami badania spirometrycznego, ale także dane kliniczne dotyczące pacjenta: liczbę zaostrzeń POChP w ciągu roku oraz nasilenie objawów klinicznych objawów na podstawie wyników mMRC (tab. 3) i testu oceny POChP (CAT) (tab. 9).
Wiadomo, że „złotym standardem” oceny wpływu objawów na jakość życia są wyniki Kwestionariusza Oddechowego Św. Jerzego (SGRQ), czyli jego skala „objawów”. Test oceniający CAT, a ostatnio Kwestionariusz Kliniczny POChP (CCQ), są coraz szerzej stosowane w praktyce klinicznej.
W badaniu GOLD 2013 ocenę objawów poszerzono o zastosowanie skali CCQ, która pozwala zobiektywizować objawy zarówno za 1 dzień, jak i za ostatni tydzień oraz nadać im charakterystykę nie tylko jakościową, ale także kliniczną (tab. 10). .
Końcowy wynik obliczany jest z sumy punktów uzyskanych za udzielenie odpowiedzi na wszystkie pytania i dzielonej przez 10. Wraz z jego wartością<1 симптомы оцениваются как невыраженные, а при ≥1 - выраженные, т. е. оказывающие влияние на жизнь пациента. Вместе с тем еще окончательно не установлены значения CCQ, соответствующие выраженному влиянию симптомов на КЖ, эквивалентные значениям SGRQ. Пограничными значениями отличия выраженных от невыраженных симптомов предлагаются значения 1,0-1,5 (GOLD 2014).
Klasyfikację POChP z uwzględnieniem zaleceń programu GOLD przedstawiono w tabeli 11.
Oceniając ryzyko, zaleca się wybór najwyższego stopnia na podstawie ograniczenia przepływu powietrza w trybie GOLD lub historii zaostrzeń.
W nowym wydaniu GOLD z 2013 r. dodano zapis, że jeśli w poprzednim roku u pacjenta wystąpiło chociaż jedno zaostrzenie, które doprowadziło do hospitalizacji (tj. ciężkie zaostrzenie), należy go zakwalifikować do grupy wysokiego ryzyka.
Zatem integralna ocena wpływu POChP na konkretnego pacjenta łączy ocenę objawów z klasyfikacją spirometryczną z oceną ryzyka zaostrzeń.
Mając to na uwadze, rozpoznanie POChP może wyglądać następująco:
„Przewlekła obturacyjna choroba płuc…”, a następnie ocena następuje:
- stopień nasilenia (I-IV) niedrożności oskrzeli;
- nasilenie objawów klinicznych: wyraźne (CAT ≥10, mMRC ≥2, CCQ ≥1), niewyraźne (CAT<10, mMRC <2, CCQ <1);
- częstość zaostrzeń: rzadkie (0-1), częste (≥2);
- fenotyp POChP (jeśli to możliwe);
- choroby współistniejące.
Rola chorób współistniejących jest niezwykle istotna w ocenie ciężkości POChP, jednak nawet w najnowszej rekomendacji GOLD z 2013 roku nie znalazła ona godnego miejsca w danej klasyfikacji.
8. Terapia stabilnej POChP
Głównym celem leczenia jest zapobieganie postępowi choroby. Cele leczenia opisano w Tabeli 12.
Główne obszary leczenia:
I. Efekty niefarmakologiczne:
- ograniczenie wpływu czynników ryzyka;
- programy edukacyjne.
Niefarmakologiczne metody narażenia przedstawiono w tabeli 13.
U pacjentów z ciężką chorobą (GOLD 2-4) jako konieczne postępowanie należy zastosować rehabilitację pulmonologiczną.
II. Farmakoterapia
O wyborze dawki leczenia farmakologicznego decyduje nasilenie objawów klinicznych, wartość FEV1 po podaniu leku rozszerzającego oskrzela oraz częstość zaostrzeń choroby (tab. 14, 15).
Schematy leczenia farmakologicznego chorych na POChP, opracowane z uwzględnieniem kompleksowej oceny ciężkości POChP (częstotliwość zaostrzeń choroby, nasilenie objawów klinicznych, stopień zaawansowania POChP, określony przez stopień obturacji oskrzeli), podano w: Tabela 16.
Inne metody leczenia obejmują tlenoterapię, wspomaganie oddychania i operację.
Terapia tlenowa
Stwierdzono, że długotrwałe podawanie tlenu (O2) (>15 godzin/dobę) zwiększa przeżycie u pacjentów z przewlekłą DN i ciężką hipoksemią w spoczynku (B, 2++).
Wsparcie oddechowe
Wentylacja nieinwazyjna (NIV) jest szeroko stosowana u pacjentów z wyjątkowo ciężką, stabilną POChP.
Połączenie NIV z długoterminową tlenoterapią może być skuteczne u wybranych pacjentów, szczególnie w przypadku oczywistej hiperkapnii w ciągu dnia.
Chirurgia
Chirurgia zmniejszająca objętość płuc (LVLR)
VAOL wykonuje się poprzez usunięcie części płuc w celu ograniczenia hiperinflacji i uzyskania bardziej wydajnego pompowania mięśni oddechowych. Jego stosowanie przeprowadza się u pacjentów z rozedmą górnego płata płuc i niską tolerancją wysiłku.
Przeszczep płuc
Przeszczep płuc może poprawić jakość życia i wyniki funkcjonalne u starannie wybranych pacjentów z bardzo ciężką POChP. Kryteriami wyboru są FEV1<25% от должной величины, РаО2 <55 мм рт. ст., РаСО2 >50 mmHg Sztuka. podczas oddychania powietrzem pokojowym i nadciśnieniem płucnym (Ppa > 40 mm Hg).
9. Zaostrzenie POChP
Definicja i znaczenie zaostrzeń POChP
Charakterystyczną cechą przebiegu POChP jest rozwój zaostrzeń. Według definicji GOLD (2013): „Zaostrzenie POChP to ostre zdarzenie charakteryzujące się pogorszeniem objawów ze strony układu oddechowego, które wykracza poza normalne dzienne wahania i prowadzi do zmiany dotychczasowego leczenia”.
Zaostrzenie POChP jest jedną z najczęstszych przyczyn zgłaszania się pacjentów do lekarza w nagłych przypadkach. Częsty rozwój zaostrzeń u chorych na POChP prowadzi do długotrwałego (do kilku tygodni) pogorszenia funkcji oddechowych i wymiany gazowej, szybszej progresji choroby, znacznego obniżenia jakości życia chorych i wiąże się z: znaczne koszty ekonomiczne leczenia. Ponadto zaostrzenia POChP prowadzą do dekompensacji współistniejących chorób przewlekłych. Ciężkie zaostrzenia POChP są główną przyczyną zgonów pacjentów. W ciągu pierwszych 5 dni od wystąpienia zaostrzeń ryzyko wystąpienia AMI wzrasta ponad 2-krotnie.
Klasyfikacja zaostrzeń POChP
Jedną z najbardziej znanych klasyfikacji ciężkości zaostrzeń POChP, zaproponowaną przez grupę roboczą ds. definicji zaostrzeń POChP, przedstawiono w tabeli 17.
Steer i in. opracowali nową skalę do oceny rokowania u chorych z zaostrzeniem POChP hospitalizowanych w szpitalu. Zidentyfikowano 5 najsilniejszych predyktorów zgonu: 1) nasilenie duszności według skali eMRCD; 2) eozynopenia krwi obwodowej (<0,05 клеток x109/л); 3) признаки консолидации паренхимы легких по данным рентгенографии грудной клетки; 4) ацидоз крови (pH <7,3) и 5) мерцательная аритмия. Перечисленные признаки были объединены в шкалу DECAF (по аббревиатуре первых букв в английской транскрипции) (табл. 17).
Wynik ten wykazał doskonałą moc różnicującą w przewidywaniu śmiertelności podczas zaostrzenia POChP.
Przyczyny zaostrzeń
Najczęstszymi przyczynami zaostrzeń POChP są bakteryjne i wirusowe infekcje dróg oddechowych oraz zanieczyszczenia powietrza, ale nie można ustalić przyczyny około 20–30% zaostrzeń.
Wśród bakterii podczas zaostrzenia POChP najważniejszą rolę odgrywają nietypowalne Haemophilus influenzae, Streptococcus pneumoniae i Moraxella catarrhalis. Badania z udziałem pacjentów z ciężkim zaostrzeniem POChP wykazały, że u tych pacjentów częściej mogą występować Gram-ujemne bakterie Enterobacteriaceae i Pseudomonas aeruginosa (Tabela 18).
Rinowirusy są jedną z najczęstszych przyczyn ostrych infekcji wirusowych dróg oddechowych i mogą być istotną przyczyną zaostrzeń POChP. Zauważono, że zaostrzenia POChP najczęściej rozwijają się w miesiącach jesienno-zimowych. Zwiększenie liczby zaostrzeń POChP może wiązać się ze wzrostem częstości występowania infekcji wirusowych dróg oddechowych w miesiącach zimowych i wzrostem wrażliwości nabłonka górnych dróg oddechowych na nie w okresie zimowym.
Do schorzeń, które mogą przypominać zaostrzenia i/lub zaostrzać ich przebieg, zalicza się zapalenie płuc, zatorowość płucną, zastoinową niewydolność serca, zaburzenia rytmu, odmę opłucnową i wysięk opłucnowy. Należy odróżnić te stany od zaostrzeń i, jeśli występują, zastosować odpowiednie leczenie.
10. Terapia zaostrzeń POChP
Taktykę postępowania u chorych na POChP o różnym stopniu nasilenia zaostrzenia przedstawiono w Tabeli 19.
Wziewne leki rozszerzające oskrzela
Przepisywanie wziewnych leków rozszerzających oskrzela jest jednym z głównych ogniw leczenia zaostrzenia POChP (A, 1++). Tradycyjnie pacjentom z zaostrzeniem POChP przepisuje się albo szybko działające β2-mimetyki (salbutamol, fenoterol), albo szybko działające leki antycholinergiczne (bromek ipratropium). Skuteczność β2-mimetyków i bromku ipratropium w zaostrzeniu POChP jest w przybliżeniu taka sama (B, 2++), zaletą β2-mimetyków jest szybszy początek działania, a leki przeciwcholinergiczne charakteryzują się wysokim bezpieczeństwem i dobrą tolerancją. Obecnie wielu ekspertów uważa terapię skojarzoną β2-agonistą i bromkiem ipratropium za optymalną strategię leczenia zaostrzeń POChP (B, 2++), szczególnie w leczeniu chorych na POChP z ciężkimi zaostrzeniami.
GKS
Według badań klinicznych dotyczących zaostrzeń POChP wymagających hospitalizacji pacjentów, kortykosteroidy podawane ogólnoustrojowo skracają czas wystąpienia remisji, poprawiają czynność płuc (FEV1) i zmniejszają hipoksemię (PaO2), a także mogą zmniejszać ryzyko wczesnych nawrotów i niepowodzenia leczenia, skrócić czas pobytu w szpitalu (A, 1+). Zwykle zaleca się doustną terapię prednizolonem w dawce 30-40 mg/d przez 5-14 dni (B, 2++). Według najnowszych danych, najlepszą odpowiedź na kortykosteroidy podawane ogólnie (C, 2+) mają pacjenci z zaostrzeniem POChP i eozynofilią we krwi >2%.
Bezpieczniejszą alternatywą dla kortykosteroidów stosowanych ogólnoustrojowo w zaostrzeniu POChP są kortykosteroidy wziewne, zwłaszcza kortykosteroidy w nebulizacji (B, 2++).
Terapia antybakteryjna (ABT)
Ponieważ bakterie nie są przyczyną wszystkich zaostrzeń POChP (50%), ważne jest ustalenie wskazań do przepisania ABT w przypadku zaostrzeń. Aktualne wytyczne zalecają przepisywanie antybiotyków pacjentom z najcięższym zaostrzeniem POChP, np. z zaostrzeniami typu I według klasyfikacji Anthonisena (tj. w przypadku wzmożonej duszności, zwiększonej objętości i stopnia ropnej plwociny) lub z typem II zaostrzenia (obecność 2 z 3 wymienionych cech) (B, 2++). U pacjentów z podobnymi scenariuszami zaostrzeń POChP najskuteczniejsze są antybiotyki, ponieważ przyczyną takich zaostrzeń jest infekcja bakteryjna. Antybiotyki zaleca się także pacjentom z ciężkim zaostrzeniem POChP wymagającym leczenia inwazyjnego lub NIV (D, 3). Zastosowanie biomarkerów, takich jak białko C-reaktywne (CRP), pomaga ulepszyć diagnostykę i metody leczenia pacjentów z zaostrzeniem POChP (C, 2+). Wzrost stężenia CRP ≥15 mg/l w czasie zaostrzenia POChP jest czułym objawem zakażenia bakteryjnego.
Wybór najodpowiedniejszego antybiotyku w leczeniu zaostrzeń POChP zależy od wielu czynników, takich jak ciężkość POChP, czynniki ryzyka złego wyniku leczenia (na przykład starszy wiek, niskie wartości FEV1, wcześniejsze częste zaostrzenia i choroby współistniejące w przeszłości). antybiotykoterapia (D, 3)).
W przypadku łagodnych i umiarkowanych zaostrzeń POChP bez czynników ryzyka zaleca się przepisanie nowoczesnych makrolidów (azytromycyna, klarytromycyna), cefalosporyn (cefiksym itp.) (tab. 18). Jako leczenie pierwszego rzutu u pacjentów z ciężkim zaostrzeniem POChP i czynnikami ryzyka zaleca się amoksycylinę z kwasem klawulanowym lub fluorochinolon stosowany w drogach oddechowych (lewofloksacyna lub moksyfloksacyna) (B, 2++). W przypadku dużego ryzyka zakażenia P. aeruginosa należy stosować cyprofloksacynę i inne leki o działaniu przeciwpseudomonas (B, 2++).
Terapia tlenowa
Hipoksemia stwarza realne zagrożenie życia chorego, dlatego tlenoterapia jest priorytetem w leczeniu ARF na tle POChP (B, 2++). Celem tlenoterapii jest osiągnięcie PaO2 w zakresie 55-65 mm Hg. Sztuka. i SaO2 88-92%. W przypadku ARF u chorych na POChP do podawania O2 najczęściej wykorzystuje się kaniule nosowe lub maskę Venturiego. Podczas podawania O2 przez kaniule dla większości pacjentów wystarczający jest przepływ O2 na poziomie 1–2 l/min (D, 3). Maska Venturiego jest uważana za bardziej preferowaną metodę dostarczania O2, ponieważ pozwala na dość dokładne pomiary frakcji O2 w wdychanej mieszaninie (FiO2), niezależnie od wentylacji minutowej i przepływu wdechowego pacjenta. Terapia tlenowa FiO2 24% zwiększa PaO2 średnio o 10 mm Hg. Art., a przy FiO2 28% - o 20 mm Hg. Sztuka. Po rozpoczęciu lub zmianie schematu tlenoterapii, w ciągu kolejnych 30-60 minut. Zaleca się wykonanie analizy gazowej krwi tętniczej w celu monitorowania poziomu PaCO2 i pH (D, 3).
NVL
NIV – zapewnienie wspomagania wentylacji bez instalowania sztucznych dróg oddechowych. Rozwój tego nowego kierunku wspomagania oddychania umożliwia bezpieczne i skuteczne osiągnięcie odciążenia mięśni oddechowych, przywrócenie wymiany gazowej i zmniejszenie duszności u pacjentów z ARF. Podczas NIV kontakt pacjenta z respiratorem odbywa się za pomocą masek nosowych lub twarzowych (rzadziej przyłbic i ustników), pacjent jest przytomny i z reguły nie jest wymagane stosowanie środków uspokajających i zwiotczających mięśnie. Kolejną ważną zaletą NIV jest możliwość jego szybkiego zatrzymania, a także natychmiastowego wznowienia w razie potrzeby. Wskazania i przeciwwskazania do NIV podano poniżej.
Kryteria włączenia do NIV w przypadku ARF w przebiegu POChP są następujące:
1. Objawy i oznaki ARF:
- ciężka duszność w spoczynku;
- częstość oddechów >24, udział pomocniczych mięśni oddechowych w oddychaniu, paradoks brzucha.
2. Objawy zaburzeń wymiany gazowej:
- PaCO2 >45 mm Hg. Sztuka, pH<7,35;
- PaO2/FiO2<200 мм рт. ст.
Kryteriami wykluczającymi wykonanie NIV z powodu ARF są:
1. Zatrzymanie oddychania.
2. Niestabilna hemodynamika (niedociśnienie, niekontrolowane zaburzenia rytmu lub niedokrwienie mięśnia sercowego).
3. Niezdolność do ochrony dróg oddechowych (zaburzenia w kaszlu i połykaniu).
4. Nadmierne wydzielanie oskrzeli.
5. Objawy zaburzeń świadomości (pobudzenie lub depresja), brak umiejętności współpracy pacjenta z personelem medycznym.
Pacjenci z ostrą niewydolnością oddechową wymagający pilnej intubacji dotchawiczej i inwazyjnego wspomagania oddychania są uważani za nieodpowiednich kandydatów do tej metody wspomagania oddychania (C, 2+). NIV jest jedyną sprawdzoną metodą leczenia, która może zmniejszyć śmiertelność u chorych na POChP z ARF (A, 1++).
Inwazyjne wspomaganie oddychania
Wentylacja mechaniczna jest wskazana u chorych na POChP i ARF, u których leczenie farmakologiczne lub inne leczenie zachowawcze (NVL) nie prowadzi do dalszej poprawy (B, 2++). Wskazania do wentylacji powinny uwzględniać nie tylko brak skuteczności zachowawczych metod leczenia, nasilenie wskaźników czynnościowych, ale także szybkość ich rozwoju i potencjalną odwracalność procesu, który spowodował ARF.
Bezwzględnymi wskazaniami do wentylacji mechanicznej w ARF na tle zaostrzenia POChP są:
1) zatrzymanie oddechu;
2) ciężkie zaburzenia świadomości (osłupienie, śpiączka);
3) niestabilna hemodynamika (SBP)<70 мм рт. ст., частота сердечных сокращений <50/мин. или >160/min);
4) zmęczenie mięśni oddechowych.
Względne wskazania do wentylacji mechanicznej w ARF na tle zaostrzenia POChP to:
1) częstość oddechów >35/min;
2) pH krwi tętniczej<7,25;
3) RaO2<45 мм рт. ст., несмотря на проведение кислородотерапии.
Z reguły przepisując wspomaganie oddychania przeprowadza się kompleksową ocenę kliniczną i funkcjonalną stanu pacjenta. U chorych na POChP odzwyczajanie się od wentylacji mechanicznej należy rozpocząć jak najwcześniej (B, 2++), ponieważ każdy dodatkowy dzień inwazyjnego wspomagania oddychania znacząco zwiększa ryzyko powikłań związanych z wentylacją mechaniczną, zwłaszcza takich jak zapalenie płuc związane z respiratorem (A , 1+) .
Metody mobilizacji i usuwania
wydzielina oskrzelowa
Nadprodukcja wydzieliny i słaby jej oczyszczanie z dróg oddechowych może stanowić poważny problem u wielu pacjentów z ciężkim zaostrzeniem POChP.
Według najnowszych badań terapia lekami mukoaktywnymi (acetylocysteina, karbocysteina, erdosteina) przyspiesza ustąpienie zaostrzeń POChP i dodatkowo przyczynia się do zmniejszenia nasilenia ogólnoustrojowego stanu zapalnego (C, 2+).
W przypadku zaostrzenia POChP znaczną poprawę można osiągnąć stosując specjalne metody poprawiające funkcję drenażu dróg oddechowych. Na przykład wentylacja perkusyjna o wysokiej częstotliwości jest metodą terapii oddechowej, podczas której pacjentowi dostarczane są małe objętości powietrza („perkusja”) z dużą, kontrolowaną częstotliwością.
(60-400 cykli/min.) i kontrolowany poziom ciśnienia poprzez specjalny otwarty obwód oddechowy (fazytron). „Opukiwanie” może być podawane przez maskę, ustnik, rurkę dotchawiczą i tracheostomię. Inną metodą są drgania (oscylacje) ściany klatki piersiowej o wysokiej częstotliwości, które poprzez klatkę piersiową przenoszone są do dróg oddechowych i przepływających przez nie gazów. Wibracje o wysokiej częstotliwości powstają za pomocą nadmuchiwanej kamizelki, która ściśle przylega do klatki piersiowej i jest podłączona do sprężarki powietrza.
11. POChP i choroby pokrewne
POChP, obok nadciśnienia tętniczego, choroby wieńcowej i cukrzycy, stanowią wiodącą grupę chorób przewlekłych – stanowią ponad 30% wszystkich innych patologii człowieka. POChP często łączy się z tymi chorobami, co może znacząco pogorszyć rokowanie chorych.
Najczęstsze choroby współistniejące w POChP przedstawiono w tabeli 20.
U chorych na POChP ryzyko zgonu wzrasta wraz z liczbą chorób współistniejących i nie zależy od wartości FEV1 (ryc. 3).
Wszystkie przyczyny zgonów chorych na POChP przedstawiono w Tabeli 21.
Według dużych badań populacyjnych ryzyko zgonu z powodu CVD u chorych na POChP jest 2-3 razy większe w porównaniu z pacjentami w tej samej grupie wiekowej i bez POChP i stanowi około 50% całkowitej liczby zgonów.
Główną patologią towarzyszącą POChP jest patologia układu sercowo-naczyniowego. Jest to prawdopodobnie grupa najczęstszych i najpoważniejszych chorób współistniejących z POChP. Wśród nich należy wyróżnić chorobę wieńcową, przewlekłą niewydolność serca, migotanie przedsionków i nadciśnienie, które najwyraźniej jest najczęstszą współistniejącą chorobą POChP.
Często leczenie takich pacjentów budzi kontrowersje: leki (inhibitory konwertazy angiotensyny, β-adrenolityki) stosowane w chorobie niedokrwiennej serca i/lub nadciśnieniu mogą pogorszyć przebieg POChP (ryzyko kaszlu, duszności, pojawienia się lub nasilenia objawów niedrożność oskrzeli), a leki przepisywane na POChP (leki rozszerzające oskrzela, kortykosteroidy) mogą niekorzystnie wpływać na przebieg patologii układu krążenia (ryzyko wystąpienia zaburzeń rytmu serca, podwyższonego ciśnienia krwi). Jednakże leczenie CVD u chorych na POChP powinno być prowadzone zgodnie ze standardowymi zaleceniami, gdyż nie ma dowodów na to, że w przypadku POChP należy ich leczyć inaczej. Jeśli konieczne jest przepisanie β-adrenolityków pacjentom z POChP ze współistniejącymi patologiami sercowo-naczyniowymi, należy preferować selektywne β-adrenolityki.
Osteoporoza i depresja to ważne choroby współistniejące, które często są niezdiagnozowane. Wiążą się jednak z pogorszeniem stanu zdrowia i złym rokowaniem. Należy unikać przepisywania powtarzanych kursów kortykosteroidów o działaniu ogólnoustrojowym w przypadku zaostrzeń, ponieważ ich stosowanie znacznie zwiększa ryzyko rozwoju osteoporozy i złamań.
W ostatnich latach coraz częstsze są przypadki połączenia zespołu metabolicznego i cukrzycy u chorych na POChP. Cukrzyca ma istotny wpływ na przebieg POChP i pogarsza rokowanie choroby. U chorych na POChP w połączeniu z cukrzycą typu 2 DN jest bardziej wyraźna, zaostrzenia są częstsze, cięższy przebieg choroby niedokrwiennej serca, stwierdza się obecność przewlekłej HF i nadciśnienia, wzrasta nadciśnienie płucne przy mniejszym nasileniu hiperinflacji.
U pacjentów z łagodną POChP najczęstszą przyczyną śmierci jest rak płuc. U pacjentów z ciężką POChP upośledzona czynność płuc znacznie ogranicza możliwość interwencji chirurgicznej w przypadku raka płuc.
12. Rehabilitacja i edukacja pacjenta
Jedną z zalecanych dodatkowych metod leczenia chorych na POChP, począwszy od II stopnia zaawansowania choroby, jest rehabilitacja pulmonologiczna. Udowodniono jego skuteczność w poprawie tolerancji wysiłku (A, 1++), codziennej aktywności, zmniejszeniu odczuwania duszności (A, 1++), nasileniu lęku i depresji (A, 1+), zmniejszeniu liczba i czas hospitalizacji (A, 1++), czas rekonwalescencji po wypisaniu ze szpitala oraz ogólnie wzrost jakości życia (A, 1++) i przeżycia (B, 2++).
Rehabilitacja pulmonologiczna to kompleksowy program interwencyjny oparty na terapii skoncentrowanej na pacjencie, obejmujący, oprócz treningu fizycznego, programy edukacyjne i psychospołeczne, których celem jest poprawa dobrostanu fizycznego i emocjonalnego pacjentów oraz zapewnienie długotrwałego przestrzegania zachowań zdrowotnych.
Zgodnie z zaleceniami ERS/ATS z 2013 r. rehabilitację należy kontynuować do
6-12 tygodni (co najmniej 12 lekcji, 2 razy w tygodniu, trwających 30 minut lub dłużej) i zawierać następujące elementy:
1) trening fizyczny;
2) korekta stanu odżywienia;
3) edukacja pacjenta;
4) wsparcie psychospołeczne.
Program ten może być prowadzony w warunkach ambulatoryjnych lub szpitalnych.
Głównym elementem rehabilitacji pulmonologicznej jest trening fizyczny, który może zwiększyć skuteczność długo działających leków rozszerzających oskrzela (B, 2++). Szczególnie ważne jest zintegrowane podejście do ich realizacji, łączące ćwiczenia siłowe i wytrzymałościowe: chodzenie, trening mięśni kończyn górnych i dolnych przy pomocy ekspanderów, hantli, stepperów oraz ćwiczenia na ergometrze rowerowym. Podczas tych treningów angażowane są także różne grupy stawów, a także rozwijana jest motoryka mała ręki.
Wszystkie ćwiczenia należy łączyć z ćwiczeniami oddechowymi mającymi na celu wyrobienie prawidłowego wzorca oddechowego, co niesie ze sobą dodatkowe korzyści (C, 2+). Dodatkowo ćwiczenia oddechowe powinny obejmować wykorzystanie specjalnych symulatorów (Threshold PEP, IMT), które w różny sposób angażują mięśnie oddechowe wdechowe i wydechowe.
Korekta stanu odżywienia powinna mieć na celu utrzymanie siły mięśniowej poprzez odpowiednią podaż białka i witamin w diecie.
Oprócz rehabilitacji ruchowej dużą uwagę należy zwrócić na działania mające na celu zmianę zachowania pacjentów, ucząc ich umiejętności samodzielnego rozpoznawania zmian w przebiegu choroby i metod ich korygowania.
* Przewlekłe choroby dróg oddechowych, Przewodnik dla lekarzy podstawowej opieki zdrowotnej, 2005.









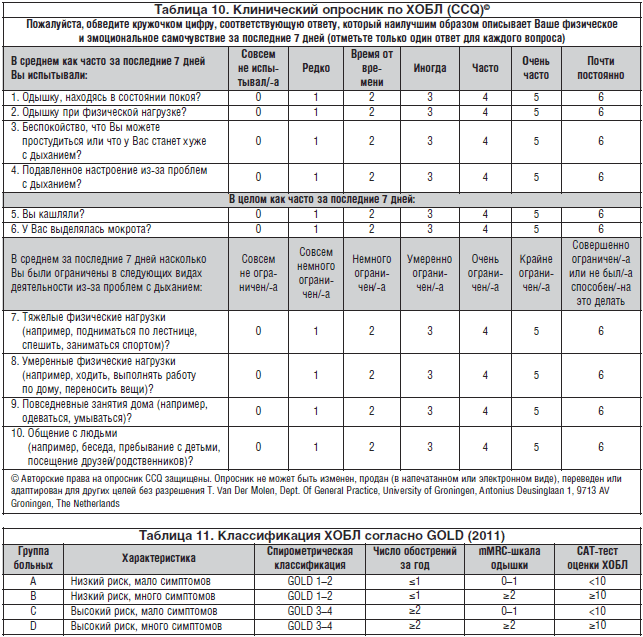






Rosyjskie Towarzystwo Oddechowe
przewlekła obturacyjna choroba płuc
Chuchalin Aleksander Grigoriewicz |
Dyrektor Federalnej Państwowej Instytucji Budżetowej „Instytut Badawczy Pulmonologii” FMBA |
Rosja, Prezes Zarządu Rosyjskiego |
|
Towarzystwo Oddechowe, szef |
|
niezależny specjalista pulmonolog |
|
Ministerstwo Zdrowia Federacji Rosyjskiej, akademik Rosyjskiej Akademii Nauk Medycznych, profesor, |
|
Aisanow Zaurbek Ramazanowicz |
Kierownik Katedry Fizjologii Klinicznej |
oraz badania kliniczne Federalnej Państwowej Instytucji Budżetowej „Instytut Badawczy”. |
|
Awdejew Siergiej Nikołajewicz |
Zastępca Dyrektora ds. Badań, |
Kierownik Oddziału Klinicznego Federalnej Państwowej Instytucji Budżetowej „Instytut Badawczy |
|
pulmonologia” FMBA Rosji, profesor, doktor nauk medycznych. |
|
Andriej Bielewski |
Profesor Katedry Pulmonologii Państwowej Budżetowej Wyższej Szkoły Zawodowej |
Stanisławowicz |
RNRMU nazwany na cześć N.I. Pirogova, głowa |
laboratorium rehabilitacyjne Federalnej Państwowej Instytucji Budżetowej „Instytut Badawczy |
|
Pulmonologia” FMBA Rosji , profesor, doktor nauk medycznych |
|
Leszczenko Igor Wiktorowicz |
Profesor Katedry Ftyzjologii i |
pulmonologia GBOU VPO USMU, szef |
|
niezależny pulmonolog Ministerstwa Zdrowia |
|
Region i departament Swierdłowska |
|
opieka zdrowotna w Jekaterynburgu, naukowa |
|
Kierownik Kliniki Lekarskiej |
|
Stowarzyszenie „Nowy Szpital”, prof. |
|
Doktor nauk medycznych, Honorowy Doktor Rosji, |
|
Meshcheryakova Natalia Nikołajewna |
Profesor nadzwyczajny, Katedra Pulmonologii, Państwowa Budżetowa Instytucja Edukacyjna Wyższego Kształcenia Zawodowego, Rosyjski Narodowy Uniwersytet Medyczny |
nazwany na cześć N.I. Pirogova, czołowy badacz |
|
laboratorium rehabilitacyjne Federalnej Państwowej Instytucji Budżetowej „Instytut Badawczy |
|
Pulmonologia” FMBA Rosji, dr hab. |
|
Ovcharenko Swietłana Iwanowna |
Profesor Katedry Terapii Wydziału nr 2 |
I Wydział Lekarski, Państwowa Budżetowa Uczelnia Wyższej Szkoły Zawodowej First |
|
MSMU im. ICH. Sechenova, profesor, doktor nauk medycznych, |
|
Honorowy Doktor Federacji Rosyjskiej |
|
Szmelew Jewgienij Iwanowicz |
Kierownik Katedry Mechanizmów Różnicowych |
diagnostyka gruźlicy Centralny Instytut Badawczy Rosyjskiej Akademii Nauk Medycznych, dr |
|
Miód. Nauk, Profesor, Doktor Nauk Medycznych, Honorowany |
|
naukowiec Federacji Rosyjskiej. |
Metodologia |
||
Definicja POChP i epidemiologia |
||
Obraz kliniczny POChP |
||
Zasady diagnostyczne |
||
Testy funkcjonalne w diagnostyce i monitorowaniu |
||
przebieg POChP |
||
Diagnostyka różnicowa POChP |
||
Współczesna klasyfikacja POChP. Wyczerpujący |
||
ocena dotkliwości. |
||
Terapia stabilnej POChP |
||
Zaostrzenie POChP |
||
Leczenie zaostrzeń POChP |
||
POChP i choroby pokrewne |
||
Rehabilitacja i edukacja pacjenta |
||
1. Metodologia
Metody stosowane w celu gromadzenia/wyboru materiału dowodowego:
wyszukiwanie w elektronicznych bazach danych.
Opis metod stosowanych w celu gromadzenia/wyboru materiału dowodowego:
Metody stosowane do oceny jakości i siły dowodów:
Konsensus ekspertów;
Opis |
||||||
dowód |
||||||
Wysokiej jakości metaanalizy, przeglądy systematyczne |
||||||
randomizowane badania kontrolowane (RCT) lub |
||||||
RCT z bardzo niskim ryzykiem błędu systematycznego |
||||||
Jakościowo przeprowadzone metaanalizy, systematyczne lub |
||||||
RCT z niskim ryzykiem błędu systematycznego |
||||||
Metaanalizy, systematyczne lub RCT wysokiego ryzyka |
||||||
błędy systematyczne |
||||||
Wysoka jakość |
przeglądy systematyczne |
badania |
||||
kontrola przypadków |
kohorta |
badania. |
||||
Wysokiej jakości recenzje badań kliniczno-kontrolnych lub |
||||||
badania kohortowe o bardzo niskim ryzyku wystąpienia skutków |
||||||
błędy zakłócające lub systematyczne oraz średnie prawdopodobieństwo |
||||||
związek przyczynowy |
||||||
Dobrze przeprowadzone badania kliniczno-kontrolne lub |
||||||
badania kohortowe z umiarkowanym ryzykiem wystąpienia działań zakłócających |
||||||
lub błędy systematyczne i średnie prawdopodobieństwo związku przyczynowego |
||||||
relacje |
||||||
Badania kliniczno-kontrolne lub kohortowe z |
||||||
wysokie ryzyko wystąpienia skutków mieszania lub systematycznego stosowania |
||||||
błędów i średniego prawdopodobieństwa związku przyczynowego |
||||||
Badania nieanalityczne (np. opisy przypadków, |
||||||
seria przypadków) |
||||||
Opinia eksperta |
||||||
Metody stosowane do analizy dowodów:
Przeglądy systematyczne z tabelami dowodowymi.
Opis metod stosowanych do analizy materiału dowodowego:
Wybierając publikacje jako potencjalne źródła dowodów, metodologia zastosowana w każdym badaniu jest sprawdzana pod kątem jej wiarygodności. Wynik badania wpływa na poziom dowodów przypisanych publikacji, co z kolei wpływa na siłę powstałych rekomendacji.
Badanie metodologiczne opiera się na kilku kluczowych pytaniach, które koncentrują się na tych cechach projektu badania, które mają istotny wpływ na ważność wyników i wniosków. Te kluczowe pytania mogą się różnić w zależności od rodzaju badań i kwestionariuszy stosowanych w celu standaryzacji procesu oceny publikacji. W zaleceniach wykorzystano kwestionariusz MERGE opracowany przez Departament Zdrowia Nowej Południowej Walii. Kwestionariusz ten został zaprojektowany tak, aby można go było poddać szczegółowej ocenie i dostosować do wymagań Rosyjskiego Towarzystwa Chorób Układu Oddechowego (RRS), aby zachować optymalną równowagę pomiędzy rygorem metodologicznym a praktycznym zastosowaniem.
Na proces oceny może oczywiście wpływać również czynnik subiektywny. Aby zminimalizować potencjalną stronniczość, każde badanie oceniano niezależnie, tj. co najmniej dwóch niezależnych członków grupy roboczej. Wszelkie różnice w ocenach były omawiane przez całą grupę jako całość. Jeżeli osiągnięcie konsensusu nie było możliwe, angażowano niezależnego eksperta.
Tabele dowodowe:
Tabele dowodowe zostały wypełnione przez członków grupy roboczej.
Metody stosowane przy formułowaniu rekomendacji:
Opis |
|
Co najmniej jedna metaanaliza, przegląd systematyczny lub RCT, |
|
wykazanie trwałości wyników |
|
Zbiór dowodów obejmujący wyniki ocenionych badań |
|
ogólną trwałość wyników |
|
ekstrapolowane dowody z badań z oceną 1++ |
|
Zbiór dowodów obejmujący wyniki ocenionych badań |
|
ogólna trwałość wyników; |
|
ekstrapolowane dowody z badań ocenionych na 2++ |
|
Dowód poziomu 3 lub 4; |
|
ekstrapolowane dowody z badań ocenionych na 2+ |
Punkty dobrych praktyk (GPP):
Analiza ekonomiczna:
Nie przeprowadzono analizy kosztów ani przeglądu publikacji farmakoekonomicznych.
Ocena eksperta zewnętrznego;
Wewnętrzna ocena ekspercka.
Te projekty zaleceń zostały zweryfikowane przez niezależnych ekspertów, których poproszono o skomentowanie przede wszystkim zakresu, w jakim interpretacja dowodów leżących u podstaw zaleceń jest zrozumiała.
Otrzymano uwagi od lekarzy podstawowej opieki zdrowotnej i lokalnych terapeutów dotyczące przejrzystości zaleceń i ich oceny znaczenia zaleceń jako narzędzia pracy w codziennej praktyce.
Wstępną wersję wysłano także do recenzenta niebędącego lekarzem w celu uzyskania komentarzy z punktu widzenia pacjenta.
Uwagi otrzymane od ekspertów zostały starannie usystematyzowane i omówione przez przewodniczącego i członków grupy roboczej. Każdy punkt został omówiony, a wynikające z niego zmiany w zaleceniach zostały odnotowane. W przypadku braku zmian zapisywano przyczyny odmowy wprowadzenia zmian.
Konsultacje i ekspertyza:
Wstępną wersję zamieszczono pod szeroką dyskusję na stronie internetowej RPO, tak aby osoby niebiorące udziału w kongresie miały możliwość wzięcia udziału w dyskusji i udoskonalenia rekomendacji.
Grupa robocza:
W celu ostatecznej weryfikacji i kontroli jakości rekomendacje zostały ponownie przeanalizowane przez członków grupy roboczej, którzy stwierdzili, że wszystkie uwagi i uwagi ekspertów zostały wzięte pod uwagę, a ryzyko błędów systematycznych przy opracowywaniu rekomendacji zostało zminimalizowane.
2. Definicja POChP i epidemiologia
Definicja
POChP jest chorobą, której można zapobiegać i którą można leczyć, charakteryzującą się utrzymującym się ograniczeniem przepływu powietrza przez drogi oddechowe, które zwykle ma charakter postępujący i wiąże się ze znaczną przewlekłą reakcją zapalną płuc na patogenne cząstki lub gazy. U niektórych pacjentów zaostrzenia i choroby współistniejące mogą wpływać na ogólne nasilenie POChP (GOLD 2014).
Tradycyjnie POChP łączy w sobie przewlekłe zapalenie oskrzeli i rozedmę płuc. Przewlekłe zapalenie oskrzeli jest zwykle definiowane klinicznie jako obecność kaszlu
wytwarzanie plwociny przez co najmniej 3 miesiące w ciągu następnych 2 lat.
Rozedmę płuc definiuje się morfologicznie jako obecność trwałego poszerzenia dróg oddechowych dystalnie od oskrzelików końcowych, związanego z zniszczeniem ścian pęcherzyków płucnych, niezwiązanego ze zwłóknieniem.
U chorych na POChP najczęściej występują oba schorzenia, a w niektórych przypadkach kliniczne ich rozróżnienie we wczesnych stadiach choroby jest dość trudne.
Pojęcie POChP nie obejmuje astmy oskrzelowej i innych chorób związanych ze słabo odwracalną obturacją oskrzeli (mukowiscydoza, rozstrzenie oskrzeli, zarostowe zapalenie oskrzelików).
Epidemiologia
Rozpowszechnienie
POChP jest obecnie problemem globalnym. W niektórych krajach świata częstość występowania POChP jest bardzo wysoka (ponad 20% w Chile), w innych mniejsza (około 6% w Meksyku). Przyczyną tej zmienności są różnice w stylu życia, zachowaniu i narażeniu ludzi na różnorodne szkodliwe czynniki.
Jedno z badań globalnych (projekt BOLD) dostarczyło wyjątkowej możliwości oszacowania częstości występowania POChP przy użyciu standardowych kwestionariuszy i testów czynnościowych płuc w populacjach dorosłych powyżej 40. roku życia, zarówno w krajach rozwiniętych, jak i rozwijających się. Częstość występowania POChP w stopniu II i wyższym (GOLD 2008) według badania BOLD wśród osób po 40. roku życia wynosiła 10,1 ± 4,8%; w tym dla mężczyzn – 11,8±7,9% i dla kobiet – 8,5±5,8%. Według badania epidemiologicznego dotyczącego częstości występowania POChP w regionie Samara (mieszkańcy w wieku 30 lat i starsi) częstość występowania POChP w całej próbie wyniosła 14,5% (mężczyźni – 18,7%, kobiety – 11,2%). Według wyników innego rosyjskiego badania przeprowadzonego w obwodzie irkuckim częstość występowania POChP u osób powyżej 18. roku życia wśród ludności miejskiej wynosiła 3,1%, a wśród ludności wiejskiej 6,6%. Częstość występowania POChP wzrasta wraz z wiekiem: w grupie wiekowej od 50 do 69 lat na tę chorobę chorowało 10,1% mężczyzn w miastach i 22,6% na wsi. Niemal co drugi mężczyzna po 70. roku życia mieszkający na wsi rozpoznał POChP.
Śmiertelność
Według WHO POChP jest obecnie czwartą najczęstszą przyczyną zgonów na świecie. Co roku na POChP umiera około 2,75 miliona osób, co stanowi 4,8% wszystkich przyczyn zgonów. W Europie śmiertelność z powodu POChP jest bardzo zróżnicowana: od 0,20 na 100 000 mieszkańców w Grecji, Szwecji, Islandii i Norwegii do 80 na 100 000 mieszkańców
V Ukrainie i Rumunii.
W okres od 1990 do 2000 roku śmiertelność od choroby układu krążenia
V ogółem i z powodu udaru zmniejszyła się odpowiednio o 19,9% i 6,9%, podczas gdy śmiertelność z powodu POChP wzrosła o 25,5%. Szczególnie wyraźny wzrost umieralności z powodu POChP obserwuje się wśród kobiet.
Czynnikami predykcyjnymi śmiertelności u chorych na POChP są takie czynniki, jak stopień obturacji oskrzeli, stan odżywienia (wskaźnik masy ciała), wytrzymałość fizyczna w teście 6-minutowego marszu oraz nasilenie duszności, częstotliwość i nasilenie zaostrzeń, nadciśnienie płucne. .
Głównymi przyczynami zgonów chorych na POChP są niewydolność oddechowa (RF), rak płuc, choroby układu krążenia oraz nowotwory o innej lokalizacji.
Społeczno-ekonomiczne znaczenie POChP
W W krajach rozwiniętych całkowite koszty ekonomiczne związane z POChP zajmują w strukturze chorób płuc 2. miejsce po raku płuc i 1. miejsce
w kosztach bezpośrednich 1,9-krotnie przewyższają koszty bezpośrednie astmy oskrzelowej. Koszty ekonomiczne na pacjenta związanego z POChP są trzykrotnie wyższe niż w przypadku pacjenta z astmą oskrzelową. Z nielicznych raportów na temat bezpośrednich kosztów leczenia POChP wynika, że ponad 80% kosztów przeznacza się na opiekę szpitalną, a niecałe 20% na opiekę ambulatoryjną. Stwierdzono, że 73% kosztów przypada na 10% pacjentów z ciężką chorobą. Największe szkody ekonomiczne wiąże się z leczeniem zaostrzeń POChP. W Rosji obciążenie ekonomiczne POChP, biorąc pod uwagę koszty pośrednie, w tym absencję (absencję) i prezenteizm (mniejsza efektywność pracy ze względu na zły stan zdrowia), wynosi 24,1 miliarda rubli.
3. Obraz kliniczny POChP
W warunkach narażenia na czynniki ryzyka (palenie tytoniu czynne i bierne, zanieczyszczenia egzogenne, paliwo bioorganiczne itp.) POChP zwykle rozwija się powoli i postępuje stopniowo. Osobliwością obrazu klinicznego jest to, że przez długi czas choroba postępuje bez wyraźnych objawów klinicznych (3, 4; D).
Pierwszymi objawami, z którymi pacjenci zgłaszają się do lekarza, jest kaszel, często z odkrztuszaniem plwociny i/lub duszność. Objawy te są najbardziej widoczne rano. W zimnych porach roku występują „częste przeziębienia”. Jest to obraz kliniczny początku choroby, którą lekarz uważa za przejaw zapalenia oskrzeli palacza, a diagnoza POChP na tym etapie praktycznie nie jest stawiana.
Przewlekły kaszel, będący zwykle pierwszym objawem POChP, jest często bagatelizowany przez pacjentów, uznawany za spodziewaną konsekwencję palenia i/lub narażenia na niekorzystne czynniki środowiskowe. Pacjenci zwykle wytwarzają niewielką ilość lepkiej plwociny. Zwiększony kaszel i plwocina występuje najczęściej w miesiącach zimowych, podczas zaostrzeń infekcyjnych.
Duszność jest najważniejszym objawem POChP (4; D). Często jest powodem poszukiwania pomocy lekarskiej i główną przyczyną ograniczenia aktywności zawodowej pacjenta. Wpływ duszności na zdrowie ocenia się za pomocą kwestionariusza British Medical Council (MRC). Początkowo duszność pojawia się przy stosunkowo dużej aktywności fizycznej, takiej jak bieganie po równym podłożu lub wchodzenie po schodach. W miarę postępu choroby duszność nasila się i może ograniczać nawet codzienną aktywność, a później pojawia się w spoczynku, zmuszając pacjenta do pozostania w domu (tab. 3). Ponadto ocena duszności w skali MRC jest czułym narzędziem przewidywania przeżycia chorych na POChP.
Tabela 3. Ocena duszności w skali duszności Medical Research Council Scale (MRC).
Opis |
|||
Duszność odczuwam tylko podczas intensywnego wysiłku fizycznego. |
|||
obciążenie |
|||
Brakuje mi tchu, gdy szybko idę po równym podłożu lub |
|||
wchodząc na łagodne wzgórze |
|||
Duszność powoduje, że wolniej chodzę po równym podłożu, |
|||
niż ludzie w tym samym wieku, albo to mnie powstrzymuje |
|||
oddycham, kiedy jak zwykle chodzę po równym podłożu |
|||
tempo dla mnie |
Opisując obraz kliniczny POChP, należy wziąć pod uwagę cechy charakterystyczne tej konkretnej choroby: subkliniczny początek, brak specyficznych objawów oraz stały postęp choroby.
Nasilenie objawów różni się w zależności od fazy choroby (przebieg stabilny lub zaostrzenie). Stan, w którym nasilenie objawów nie zmienia się istotnie na przestrzeni tygodni, a nawet miesięcy, należy uznać za stabilny, a w tym przypadku progresję choroby można wykryć dopiero po długotrwałej (6-12 miesięcy) obserwacji pacjenta.
Istotny wpływ na obraz kliniczny mają zaostrzenia choroby – okresowo występujące pogorszenie stanu zdrowia (trwające co najmniej 2-3 dni), któremu towarzyszy wzrost nasilenia objawów i zaburzeń czynnościowych. W okresie zaostrzeń następuje zwiększenie nasilenia hiperinflacji i tzw. pułapek powietrznych w połączeniu ze zmniejszonym przepływem wydechowym, co prowadzi do zwiększonej duszności, której zwykle towarzyszy pojawienie się lub nasilenie odległego świszczącego oddechu, uczucie ucisku w klatce piersiowej i zmniejszenie tolerancji wysiłku. Ponadto zwiększa się intensywność kaszlu, ilość plwociny, charakter jej separacji, zmiany koloru i lepkości (zwiększa się lub gwałtownie maleje). Jednocześnie pogarszają się wskaźniki funkcji oddychania zewnętrznego i gazów krwi: zmniejszają się wskaźniki prędkości (FEV1 itp.), Może wystąpić hipoksemia, a nawet hiperkapnia.
Przebieg POChP to naprzemienna faza stabilna i zaostrzenie choroby, ale różni się ona w zależności od osoby. Jednakże postęp POChP jest częsty, zwłaszcza jeśli pacjent w dalszym ciągu jest narażony na wdychane cząstki chorobotwórcze lub gazy.
Obraz kliniczny choroby zależy również w dużym stopniu od fenotypu choroby i odwrotnie, fenotyp determinuje charakterystykę objawów klinicznych POChP. Od wielu lat istnieje podział chorych na fenotypy rozedmowe i oskrzelowe.
Typ zapalenia oskrzeli charakteryzuje się przewagą objawów zapalenia oskrzeli (kaszel, wytwarzanie plwociny). Rozedma płuc w tym przypadku jest mniej wyraźna. Przeciwnie, w typie rozedmowym rozedma płuc jest głównym objawem patologicznym, duszność przeważa nad kaszlem. Jednak w praktyce klinicznej bardzo rzadko udaje się rozróżnić fenotyp POChP w postaci rozedmy lub zapalenia oskrzeli w tzw. „czysta” forma (bardziej poprawne byłoby mówienie o głównie zapaleniu oskrzeli lub głównie rozedmowym fenotypie choroby). Cechy fenotypów przedstawiono bardziej szczegółowo w tabeli 4.
Tabela 4. Cechy kliniczne i laboratoryjne dwóch głównych fenotypów POChP.
Osobliwości |
zewnętrzny |
Zmniejszone odżywianie |
Zwiększone odżywianie |
|||
Różowa cera |
Rozproszona sinica |
|||||
Kończyny są zimne |
Kończyny są ciepłe |
|||||
Dominujący objaw |
||||||
Skąpy – często śluzowy |
Obfite – często śluzowe |
|||||
Infekcja oskrzeli |
||||||
Serce płucne |
||||||
etap końcowy |
||||||
Radiografia |
hiperinflacja, |
Osiągać |
płucny |
|||
klatka piersiowa |
pęcherzowy |
zmiany, |
zwiększyć |
|||
serce „pionowe”. |
wielkość serca |
|||||
Hematokryt,% |
||||||
PaO2 |
||||||
PaCO2 |
||||||
Dyfuzja |
mały |
|||||
umiejętność |
spadek |
|||||
Jeżeli nie da się rozróżnić przewagi jednego lub drugiego fenotypu, należy mówić o fenotypie mieszanym. W warunkach klinicznych częściej występują pacjenci z mieszanym typem choroby.
Oprócz powyższego obecnie identyfikuje się inne fenotypy choroby. Przede wszystkim dotyczy to tzw. fenotypu nakładania się (połączenie POChP i astmy). Chociaż konieczne jest dokładne różnicowanie chorych na POChP i astmę oraz znacząca różnica w przebiegu przewlekłego stanu zapalnego w tych chorobach, u niektórych chorych POChP i astma mogą występować jednocześnie. Fenotyp ten może rozwinąć się u palących pacjentów cierpiących na astmę oskrzelową. Jednocześnie w wyniku szeroko zakrojonych badań wykazano, że u około 20–30% chorych na POChP może występować odwracalna obturacja oskrzeli, a podczas stanu zapalnego w składzie komórkowym pojawiają się eozynofile. Niektórych z tych pacjentów można również przypisać fenotypowi „POChP + BA”. Tacy pacjenci dobrze reagują na terapię kortykosteroidami.
Innym fenotypem, o którym ostatnio donoszono, są pacjenci z częstymi zaostrzeniami (2 lub więcej zaostrzeń w roku lub 1 lub więcej zaostrzeń prowadzących do hospitalizacji). O znaczeniu tego fenotypu decyduje fakt, że pacjent wychodzi z zaostrzenia z obniżonymi wskaźnikami czynnościowymi płuc, a częstość zaostrzeń bezpośrednio wpływa na długość życia chorych i wymaga indywidualnego podejścia do leczenia. Identyfikacja wielu innych fenotypów wymaga dalszych wyjaśnień. W kilku ostatnich badaniach zwrócono uwagę na różnice w obrazie klinicznym POChP u mężczyzn i kobiet. Jak się okazało, kobiety charakteryzują się wyraźniejszą nadreaktywnością dróg oddechowych, zgłaszają wyraźniejszą duszność przy takim samym stopniu obturacji oskrzeli jak u mężczyzn itp. Przy tych samych wskaźnikach funkcjonalnych natlenienie występuje lepiej u kobiet niż u mężczyzn. Jednak kobiety częściej zapadają na zaostrzenia, wykazują mniejszą skuteczność ćwiczeń fizycznych w programach rehabilitacyjnych i gorzej oceniają jakość swojego życia według standardowych kwestionariuszy.
Powszechnie wiadomo, że u pacjentów z POChP występują liczne pozapłucne objawy choroby, wynikające z ogólnoustrojowego działania przewlekłej choroby płuc.
